Oxidationszahlen
Download Oxidationszahlen (PDF, 85 KB)
Download Oxidationszahlen (DOC, 86 KB)
Download Oxidationszahlen (ODT, 45 KB)
Download Oxidationszahlen Lösung (PDF, 12 KB)
Download Oxidationszahlen Lösung (DOC, 93 KB)
Download Oxidationszahlen Lösung (ODT, 30 KB)
Oxidationszahlen sind formale Hilfsmittel, um bei komplizierteren Redoxreaktionen den Vorgang der Elektronenübertragung besser zu erkennen. Die Übertragung der Elektronen von einem Atom auf ein anderes zeigt sich daran, dass sich die Oxidationszahl des einen (das Elektronen abgibt) erhöht, die des anderen (das Elektronen aufnimmt) verringert.
Unter der Oxidationszahl (OZ) versteht man diejenige positive oder negative Ladung, die den Atomen eines Moleküls oder zusammengesetzten Ions (z.B. H3O+, SO42-) zugeschrieben werden müsste, wenn dieses vollständig aus Ionen aufgebaut wäre.
Die bindenden Elektronen werden jeweils dem elektronegativeren Element zugeordnet.
Zur Unterscheidung von realen Ionenladungen wird die Oxidationszahl als römische Ziffer über das Elementsymbol geschrieben. Nach IUPAC muss das „+“ vor positiven Oxidations-zahlen nicht formuliert werden.
Regeln
- Ein einzelnes Atom oder ein Atom in einem Element hat die Oxidationszahl = 0 (z. B. in O2, Mg,H2).
- Die Oxidationszahl eines einatomigen Ions ist identisch mit seiner Ionenladung.
- Alle Metalle sowie Bor und Silicium haben in ihren Verbindungen immer positive Oxidationszahlen.
+I-I +II -I +III -I +IV -I
Beispiel: NaCl, MgCl2, BCl3, SiF4 - Fluor erhält immer die Oxidationszahl -I.
- Wasserstoff erhält die Oxidationszahl +I.
+I-I
Beispiel: HCl
(Ausnahme: Alkali- und Erdalkalihydride wie NaH) - Sauerstoff erhält die Oxidationszahl -II, soweit sich nicht durch a. oder b. eine andere Oxidationszahl ergibt.
- Summe der Oxidationszahlen der Atome = Gesamtladung der Verbindung.
Übungsbeispiele:
+I+IV-II
H2CO3 2 x (+1) + 1 x (+IV) + 3 x (-II) = 0
+V-II
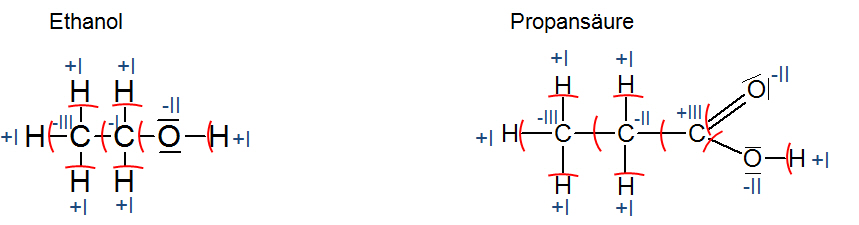
NO3 1 x (+V) + 3 x (-II) = -1 - In einer (organischen) Verbindung werden die Oxidationszahlen ermittelt, indem man immer dem elektronegativeren Partner die Elektronen zuteilt.
Man zählt:
- für jede Bindung zu einem elektropositiveren Atom: -I
- für jede Bindung zu einem identischen Atom: 0
- für jede Bindung zu einem elektronegativeren Atom: +I
Beispiel: Phosphorsäure (H3PO4)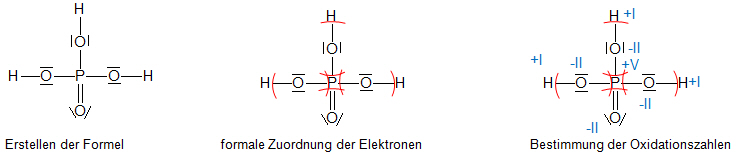
- Zunächst wird die Lewis-Formel aufgezeichnet.
- Anschließend werden die Elektronen den Atomen nach der Elektronegativität zugeordnet.
- Beispiel: Sauerstoff besitzt sechs Valenzelektronen (VI. Hauptgruppe). Auf Grund der höheren Elektronegativität des Sauerstoffs sind die Bindungselektronen zwischen dem Sauerstoff und dem Wasserstoff (oder dem Phosphor) dem Sauerstoff zuzuordnen. In der Bilanz erhält der Sauerstoff dadurch zusätzlich zu den sechs vorhandenen zwei weitere Elektronen. Daher ist die Oxidationszahl −II. Der Phosphor steht in der V. Hauptgruppe, hat also fünf Valenzelektronen. Da diese alle dem Sauerstoff zugeordnet werden, „fehlen“ ihm fünf Elektronen, und er erhält die Oxidationszahl +V.
Achtung: Vor allem in organischen Molekülen sind auch ungerade Oxidationszahlen möglich.
Übungsbeispiele:
- Ermitteln Sie für folgende Verbindungen die Oxidationszahlen:
+I-I +II+IV-II +I+III-II +I+VII-II +I+VI-II +I-I +I-II +II-II H2O2 CaCO3 KNO2 NaMnO4 K2Cr2O7 LiH Cu2O CuO