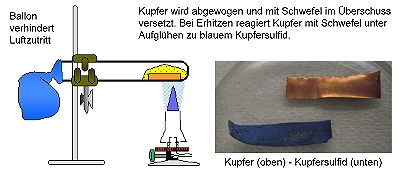
Synthese von Kupfersulfid aus den Elementen
Empfehlung:
Experiment als Demonstrationsversuch zeigen, dann die Ergebnisse von Versuchsreihen vorgeben und mit der Klasse auswerten.
Reaktionsgleichung in Worten:
Kupfer und Schwefel reagieren exotherm zu Kupfersulfid.
Der überschüssige Schwefel kann durch Erhitzen abgetrennt und dann das so erhaltene Reaktionsprodukt (Kupfersulfid) gewogen werden. Da der Massenerhaltungssatz gilt, kann man die Masse des jeweils umgesetzten Schwefels berechnen.
Quantitative Synthese von Kupfersulfid aus den Elementen
Ergebnisse einer Versuchsreihe
Aus den Werten für Kupfer und Kupfersulfid lassen sich die Massen für Schwefel und die jeweiligen Massenverhältnisse ermitteln. Wenn Sie dem Link folgen bekommen Sie eine Anleitung zur Auswertung einer Versuchsreihe mit Hilfe eines Tabellenkalkulationsprogramms.
Arbeitsanleitung
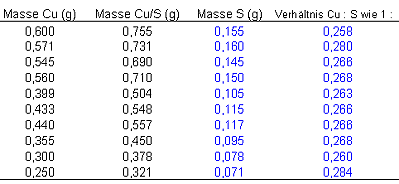
Das Massenverhältnis bei der Synthese von Kupfersulfid ist:
Cu : S = 1 : 0,268 Mittelwert dieser Versuchsreihe
Cu : S = 1 : 0,2528 Literaturwert
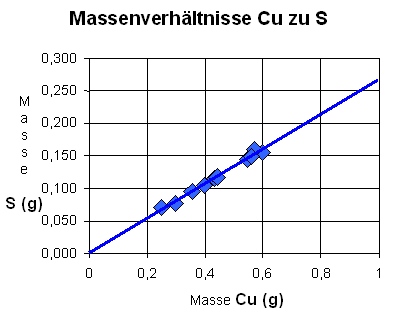
Graphische Auswertung
mögliche Aufgaben:
- Berechne mit Hilfe des Massenverhältnisses (Cu : S = 1 : 0,2528) wieviel Prozent Kupfer und wieviel Prozent Schwefel in der Verbindung Kupfersulfid enthalten sind.
- Ermittle aus dem Diagramm wieviel Schwefel zur Umsetzung von 0,5g Kupfer gebraucht werden. Welche Masse hätte dieses Reaktionsprodukt?
- In der Natur kommt Kupfersulfid als Mineral recht häufig vor und wird Chalkosin genannt. Berechne wieviel Kupfer aus 25 t Chalkosin maximal gewonnen werden könnten.



