Atombau
1. Geschichtlicher Überblick
Einen kurz gefassten und allgemein verständlichen Überblick zur Entwicklung der Vorstellungen vom Atombau (Demokrit bis Kimball, ohne Berücksichtigung des Orbital-Modells) finden Sie auf den Seiten von Aabdahl-Chemie. |
 |
2. Grundlegendes zu Atommodellen
Gerade in der Chemie sind zur Erklärung chemischer und physikalischer Vorgänge „Bilder“ notwendig, die die Teilchenebene „sichtbar machen“. Zunächst unverständliche Vorgänge werden in einfachen Modellen verständlicher - begreifbar, vorstellbar. Die Teilchenebene wird auf den sichtbaren Bereich vergrößert.
In den Naturwissenschaften wurden im Lauf der Zeit etliche zum Teil sehr unterschiedliche Atom-Modelle entwickelt. Immer wenn neue Erkenntnisse zum Aufbau der Atome entdeckt wurden, fand das auch in neuen Modellen Ausdruck. So gibt es heute eine Vielzahl von Modellvorstellungen zum Atombau. Sie existieren nebeneinander, so wie es auch nebeneinander verschiedene Musikstile und Musikrichtungen gibt (Beat, Rock, Pop, Rap, Hip Hop, Klassik). Dabei hat jede dieser Vorstellungen ihre Berechtigung zumindest dann, wenn man den Wissensstand und die Zeit berücksichtigt in der ein neues Atommodell vorgestellt wurde.
Chemie-Anfänger sollten sich nicht verwirren lassen, wenn sie im einen oder anderen Buch verschiedene Modelle finden. Jeder nimmt eben das, was ihm besonders gut gefällt oder von dem er meint, dass damit die von ihm geschilderten Sachverhalte am besten zu verstehen sind. Um in Chemie voranzukommen, ist es nun aber nicht notwendig alle Atommodelle zu kennen. Vielmehr genügen einige, wenige, gesicherte und allgemein anerkannte Vorstellungen vom Atombau, um wesentliche Eigenschaften von Materie, ihren Eigenschaften und ihren Veränderungen zu verstehen.
3. Atommodelle mit besonderer Bedeutung für den Chemie-Unterricht.
|
|
Dalton
"Billard"-Kugelmodell
|
|
|
Rutherford
Kern-Hülle - Modell
|
 |
Frank, Hertz, Pauli, de Broglie
Heisenberg u.a
Orbitalmodell |
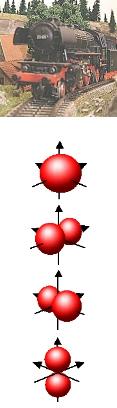
 |
Kimball Kugelwolkenmodell. |




