Aktivierungsenergie und Katalysatoren
Download Aktivierungsenergie Katalysatoren (PDF, 22 KB)
Download Aktivierungsenergie Katalysatoren (DOC, 91 KB)
Download Aktivierungsenergie Katalysatoren (ODT, 29 KB)
Download Aktivierungsenergie Katalysatoren, Lösung (PDF, 23 KB)
Download Aktivierungsenergie Katalysatoren, Lösung (DOC, 384 KB)
Download Aktivierungsenergie Katalysatoren, Lösung (ODT, 26 KB)
Eigentlich sollte man erwarten, dass Reaktionen mit großer Triebkraft, also beispielsweise stark exotherme Reaktionen, besonders schnell ablaufen. Gibt man aber z. B. Wasserstoff und Sauerstoff zusammen, so passiert zunächst nichts. Erst durch Energiezufuhr (z. B. einen Funken) kommt es zur Knallgasreaktion, also zur Bildung von Wasser.
Die Teilchen (Atome oder Moleküle der Ausgangsstoffe) brauchen beim Zusammenstoß eine bestimmte Mindestenergie, erst dann kann eine Reaktion stattfinden.
Man unterscheidet wirksame und unwirksame Zusammenstöße.
Unwirksame Zusammenstöße bleiben ohne Effekt, es entstehen keine Produkte.
Wirksame Zusammenstöße führen über Übergangszustände oder aktivierte Komplexe zur Bildung von Produkten.
Aktivierter Komplex (entspricht im Energie-Diagramm immer einem Maximum):
- Die alten Bindungen sind teilweise gelöst und die neuen schon teilweise geknüpft.
- Für den Start einer Reaktion muss daher Energie zugeführt werden, es muss eine bestimmte Energiebarriere überwunden werden.
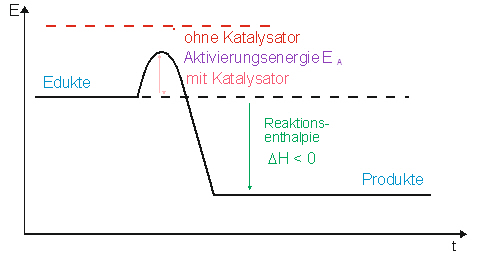
Aktivierungsenergie: Differenz zwischen der Energie des Ausgangszustands und des Übergangszustands.
Aktivierungsenergie ist die zur Auslösung einer chemischen Reaktion zuzuführende Energie.
Energiediagramm
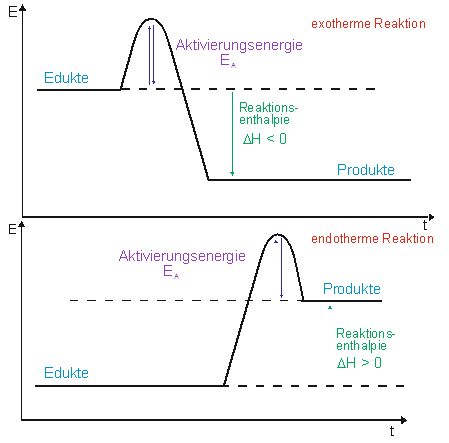
Katalysatoren
+ erhöhen die Reaktionsgeschwindigkeit einer chemischen Reaktion.
+ setzen die Aktivierungsenergie herab.
+ werden dabei selbst nicht verbraucht.