Gruppenarbeit: Zwischenmolekulare Kräfte
Download Gruppenarbeit zwischenmolekulare Kräfte (PDF, 240 KB)
Download Gruppenarbeit zwischenmolekulare Kräfte (DOCX, 470 KB)
Download Gruppenarbeit zwischenmolekulare Kräfte Lösung (PDF, 20 KB)
Download Gruppenarbeit zwischenmolekulare Kräfte Lösung (DOCX, 70 KB)
Expertengruppe A
Zwischenmolekulare Kräfte
Allgemeines
Zwischenmolekulare Kräfte dürfen nicht mit der Kovalenzbindung verwechselt werden. Bei der Kovalenzbindung geht es um Kräfte innerhalb der Moleküle (= intramolekulare Kräfte), die zwischenmolekularen Kräfte beschreiben Wechselwirkungen zwischen Molekülen (intermolekulare Kräfte).
Bindungen innerhalb von Molekülen sind in der Regel stärker als Bindungen zwischen Molekülen. Dies äußert sich in der Tatsache, dass sich die meisten Substanzen schmelzen lassen, ohne dass sich die Moleküle bei der Schmelztemperatur zersetzen. Einige Stoffe zersetzen sich, bevor sie schmelzen (z. B. Holz, Zucker, ...). Hier sind die zwischenmolekularen Kräfte stärker als die Kovalenzbindungen, welche bei der Zersetzung aufgebrochen werden.
Beim Schmelzen werden zwischenmolekulare Kräfte gelockert.
Beim Sieden werden zwischenmolekulare Kräfte aufgebrochen.
Beim Zersetzen werden Kovalenzbindungen aufgebrochen.
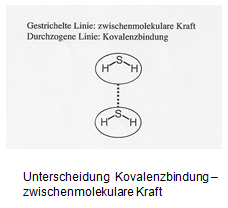
Aufgabe 1
Wirken zwischen Wassermolekülen (Siedepunkt von Wasser: 100 °C) oder zwischen Ethanolmolekülen (Siedepunkt von Ethanol: 78 °C) die stärkeren zwischenmolekularen Kräfte?
Zwischen Wassermolekülen wirken stärkere Kräfte. Dies erkennt man am höheren Siedepunkt des Wassers – beim Sieden werden die Kräfte zwischen den kleinsten Teilchen eines Stoffes aufgebrochen; je stärker die Kräfte, desto höher der Siedepunkt.
Aufgrund ihrer Stärke unterscheidet man drei Typen zwischenmolekularer Kräfte: Wasserstoff-Brücken-Bindung – Dipol-Dipol-Wechselwirkung – Van-der-Waals-Kraft Eine Wasserstoffbrücke ist stärker als eine Dipol-Dipol-Wechselwirkung, welche wiederum die Stärke einer Van-der-Waals-Kraft übertrifft. Für die tatsächliche Kraft zwischen Molekülen ist aber auch die Anzahl der einzelnen Kräfte entscheidend. Obwohl zwischen zwei Molekülen oft verschiedene Kräfte wirken, ist eine der oben genannten Kräfte jeweils dominant. Vereinfachend sprechen wir davon, dass nur eine Kraft wirkt.
In der Tabelle sind Anziehungsenergien zwischen jeweils identischen Molekülen gegeben.
Angegeben sind jeweils Dipol-Dipol- und Van- der-Waals-Kräfte.
Anziehungsenergien zwischen Molekülen
| Substanz | Dipol-Dipol-Wechselwirkung (kJ/mol) | Van-der-Waals-Kraft | Siedepunkt (K) |
| CO | 0,0004 | 8,74 | 82 K |
| HI | 0,025 | 27,9 | 238 K |
| HBr | 0,69 | 21,9 | 206 K |
| HCl | 3,31 | 16,8 | 188 K |
| NH3 | 13,3 | 14,7 | 240 K |
| H2O | 36,4 | 9,0 | 373 K |
Aufgabe 2
Ordnen Sie den Substanzen in der Tabelle aufgrund der zwischen den Molekülen wirkenden Kräfte jeweils den richtigen Siedepunkt zu. Zur Auswahl stehen die folgenden Siedepunkte in Kelvin (K): 373, 240, 238, 206, 188, 82.
Expertengruppe B
Dipol-Dipol-Wechselwirkungen
Die Kraft zwischen gleichen oder unterschiedlichen Dipolmolekülen nennt man Dipol-Dipol-Wechselwirkung. Dabei zieht das negative Ladungszentrum des einen Dipol-Moleküls das positive Ladungszentrum des anderen an. Je größer der Dipolcharakter, je stärker polar also ein Molekül, desto stärker die Dipol-Dipol-Wechselwirkungen zwischen den Molekülen.

Aufgabe 1
Stellen Sie zwei HCl-Moleküle in der Lewis-Formel dar, zeichnen Sie die Dipol-Dipol-Wechselwirkung zwischen ihnen ein, und erläutern Sie die Wechselwirkungen in Worten.
Dipol-Dipol-Wechselwirkung = Anziehungskraft zwischen δ+ und δ-
Van-der-Waals-Kräfte
Die Tatsache, dass auch Edelgase, welche aus einzelnen Atomen aufgebaut sind, und Substanzen, welche aus unpolaren Molekülen bestehen, verflüssigt und in den Festzustand überführt werden können, spricht dafür, dass auch zwischen diesen Teilchen gewisse Kräfte wirken müssen. Die Tabelle zeigt auf, dass sich die Kräfte verschiedener Stoffe in ihrer Stärke voneinander unterscheiden.
Tab. Siedepunkte von Halogenen und Edelgasen 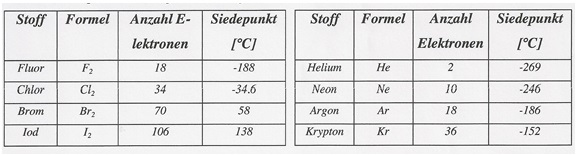
Kräfte zwischen unpolaren Molekülen werden als kurzzeitige Dipole aufgefasst. Diese kurzzeitigen Dipole kommen dadurch zustande, dass sich die Elektronen kurzzeitig an bestimmten Orten im Molekül anhäufen können. Über die Zeit gemittelt, verteilen sie sich gleichmäßig über den zur Verfügung stehenden Bereich, zu einzelnen Zeitpunkten aber kann sich die negative Ladung ungleichmäßig über das Molekül verteilen. Da es sich dabei um einen kurzzeitigen Dipol handelt, spricht man von einem temporären Dipol. Temporäre Dipole (von apolaren Molekülen), aber natürlich auch permanente Dipole (von Dipol-Molekülen) können in apolaren Molekülen die Ausbildung eines Dipols bewirken. In diesem Fall spricht man von einem induzierten (= veranlassten) Dipol.
Da sich kurzzeitige Dipole nur sehr schwach anziehen und sich auch dauernd die Richtung der Anziehungskräfte ändert, sind die resultierenden zwischenmolekularen Kräfte entsprechend klein. Größere Moleküle können aber an den vielen Stellen des Moleküls Van-der-Waals-Kräfte ausbilden, so dass die Summe dieser Kräfte entsprechend groß sein kann.
Je mehr Elektronen ein Molekül hat, desto stärker sind die davon ausgehenden Van- der-Waals-Kräfte.
Aufgabe 2
Erläutern Sie das Zustandekommen der Van-der-Waals-Kräfte.
Aufgabe 3
Hat Butan (C4H10) oder Pentan (C5H12) den höheren Siedepunkt?
Sowohl Pentan als auch Butan sind unpolare Moleküle. Zwischen ihnen wirken Van- der-Waals-Kräfte. Pentanmoleküle enthalten mehr Elektronen als Butanmoleküle. Je mehr Elektronen in einem Molekül, desto stärker die Van-der-Waals-Kräfte. Zwischen Pentanmolekülen wirken also stärkere Kräfte als zwischen Butanmolekülen; Pentan hat demnach einen höheren Siedepunkt als Butan.
Expertengruppe C
Wasserstoff-Brücken-Bindungen (kurz: H-Brücken)
Der große Unterschied des Siedepunktes zwischen Wasser (H2O, Siedepunkt 100 °C) und Schwefelwasserstoff (H2S, Siedepunkt -60 °C) lässt sich mit Dipol-Dipol-Wechselwirkungen und Van-der-Waals-Kräften allein nicht erklären. Einen solchen unerwartet hohen Siedepunkt weisen auch andere Stoffe auf z. B. NH3, HF, CH3OH. Auffällig ist, dass diese Verbindungen mindestens ein polar gebundenes H-Atom besitzen. Offenbar wirken zwischen Molekülen mit polar gebundenen H-Atomen besonders starke Kräfte. Diese Kräfte werden Wasserstoff-Brücken-Bindungen oder kurz H-Brücken genannt.
Folgende Bedingungen müssen gelten, damit H-Brücken zwischen Molekülen wirken:
Bedingung 1:
Es muss in einem Molekül ein H-Atom kovalent an ein N-, O- oder F-Atom gebunden sein. In diesen Bindungen ist das H-Atom stark d+ teilgeladen. Diese Struktur wird oft als ‚aktive Stelle’ für H-Brücken bezeichnet.
Bedingung 2:
Es muss sich im anderen Molekül ein freies, also nichtbindendes Elektronenpaar an einem N-, O- oder F-Atom befinden. Diese Orte sind stark d– teilgeladen und werden oft als ‚passive Stellen’ für H-Brücken bezeichnet.
Wasserstoffbrücken sind auch für die sogenannte Dichteanomalie des Wassers verantwortlich. Im festen Zustand weist das Molekülgitter von Eis große Lücken auf (Abbildung), welche beim Schmelzen verschwinden.
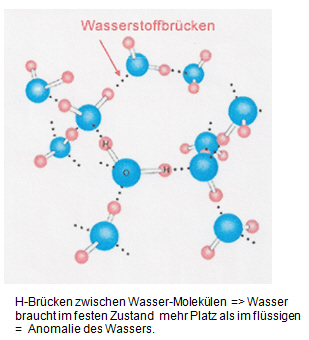
Aufgabe 1
a) Erläutern Sie das Zustandekommen der H-Brücken.
b) Sind H-Brücken stärker oder schwächer als „normale“ Dipol-Dipol-Kräfte?
Aufgabe 2
Können zwischen den folgenden Molekülen H-Brücken wirken? Bezeichnen Sie die aktiven und passiven Stellen für H-Brücken.
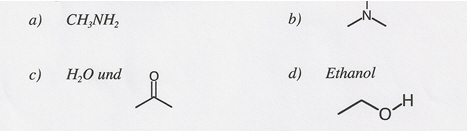
a) CH3NH2
Es können H-Brücken wirken;
aktive Stellen: H, die an N gebunden sind
passive Stelle: nichtbindendes Elektronenpaar an N.
b) NH3
Es können keine H-Brücken wirken;
aktive Stelle fehlt – kein H an O, N oder F
passive Stelle hat nichtbindendes Elektronenpaar an N.
c) H2O und
Es können H-Brücken wirken;
aktive Stelle: H-Atom an O des H2O
passive Stellen: nichtbindende Elektronenpaare an O der beiden Moleküle => H-Brücken zwischen H von H2O und O von C3H60.
d) Ethanol
Es können H-Brücken wirken;
aktive Stelle: H, das an O gebunden ist
passive Stellen: nichtbindende Elektronenpaare an O.
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


