Titration
Titration (PDF, 29 KB)
Titration (DOC, 283 KB)
Titration (ODT, 46 KB)
Titration oder Maßanalyse ist ein quantitatives Verfahren, bei dem die Bestimmung einer unbekannten Menge eines gelösten Stoffes durch Zugabe einer geeigneten Reagenzlösung bekannter Konzentration (= Titerlösung) bis zur quantitativen Umsetzung (Reaktionsendpunkt oder Äquivalenzpunkt) erfolgt.
Bei Zugabe einer Lauge zu einer Säure reagieren die Hydroxidionen der Lauge mit den Oxoniumionen der Säure zu Wasser (= Neutralisation). Dabei entsteht ein Salz aus den Metallionen der Lauge und dem Säureanion.
Am Äquivalenzpunkt (ÄP) ist die Menge der zugefügten Titerlösung derjenigen der titrierten Substanz chemisch äquivalent. Bei der Titration einer starken Säure mit einer starken Base gilt am ÄP, dass die Stoffmenge der zugegebenen Hydroxidionen gleich der Stoffmenge der Oxoniumionen der Probelösung ist: n(OH-) = n(H3O+).
Versuch
Bestimmung der Konzentration verschiedener Salzsäurelösungen und von Haushaltsessig mit Hilfe der Titration.
Reagenzien und Geräte
Durchführung
|
 |
 |
Auswertung
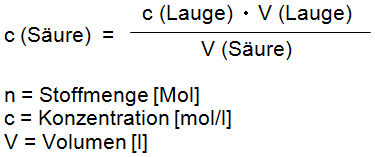
Stoffmenge n (= Anzahl der Mole) der zugefügten Lauge = Stoffmenge der eingesetzten Säure und da n = c • V folgt: c (Säure) • V (Säure) = c (Lauge) • V (Lauge)
Aufgaben
- Erstellen Sie eine Tabelle mit allen Messergebnissen und den berechneten Konzentrationen.
- Wie viel prozentig ist der Essig?
- Erstellen Sie die zugehörigen Reaktionsgleichungen zu der Titration von Salzsäure mit Natronlauge und zu der Titration von Essigsäure (CH3COOH) mit Natronlauge.



