Chemische Grundgesetze
Chemische_Grundgesetze (PDF, 13 KB)
Chemische_Grundgesetze (DOC, 39 KB)
Chemische_Grundgesetze (ODT, 18 KB)
Chemische_Grundgesetze_Loesung (PDF, 19 KB)
Chemische_Grundgesetze_Loesung (DOC, 41 KB)
Chemische_Grundgesetze_Loesung (ODT, 22 KB)
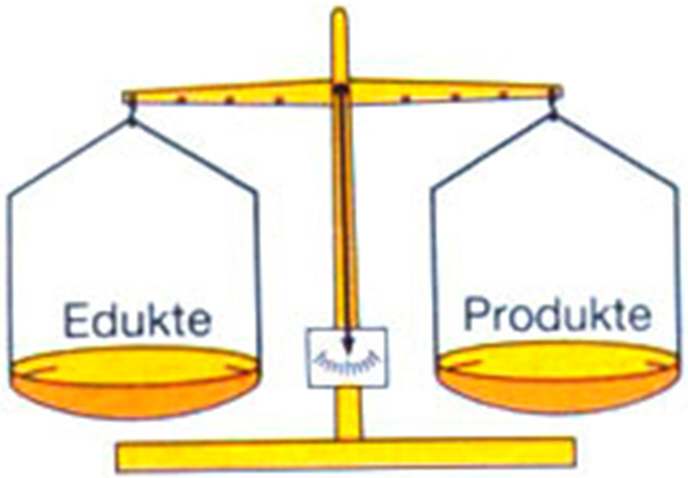
Bei einer chemischen Reaktion sind die Massen der Produkte gleich den Massen der Edukte.
Tipp: Waage verwenden, die nur eine Stelle hinter dem Komma anzeigt
Versuch: |
|||
| Schwefel und Kupfer in Reagenzglas mit Luftballon | |||
| verschlossen | → wiegen | x g | Kupfer und Schwefel |
| erhitzen, Reaktion | → wiegen | x g | Reaktionsprodukt (Kupfersulfid) |
Gesetz von der Erhaltung der Masse: Bei chemischen Reaktionen ist die Masse der Ausgangsstoffe gleich der Masse der Endprodukte.
| 800 g Kupfer | + | 800 g Schwefel | → | 1000 g Kupfersulfid |
| 800 g Kupfer | + | 400 g Schwefel | → | 1000 g Kupfersulfid |
| 800 g Kupfer | + | 200 g Schwefel | → | 1000 g Kupfersulfid |
| 800 g Kupfer | + | 100 g Schwefel | → | 900 g Kupfersulfid |
| In welchem Fall erhält man aus möglichst geringen Massen der Ausgangsstoffe die höchste Ausbeute? | ||||
800 g Kupfer+800 g Schwefel→1000 g Kupfersulfid
| 4 | 1 | |||
| Reaktionsgleichung | ||||
| 2 Cu | + | S | → | Cu2S |
| Molare Masse | ||||
| 2 x 63,5 g = 127 g | 31 g | → | 158 g | |
| 4 | 1 | |||
Gesetz der konstanten Proportionen: Die Elemente verbinden sich immer in einem bestimmten unveränderlichen Massenverhältnis → ist in der Reaktionsgleichung festgehalten.
Aufgaben
- Welche Stoffportionen müsste man einsetzen, damit man 2.500 mg Kupfersulfid erhält?
→ 2.000 mg Kupfer und 500 mg Schwefel - Wie viel Kupfersulfid erhält man, wenn man 1000 mg Kupfer und unbegrenzt viel Schwefel zur Reaktion bringt?
→ 1.250 mg Kupfersulfid aus 1.000 mg Kupfer und 250 mg Schwefel
Der Text dieser Seite ist verfügbar unter der Lizenz CC BY 4.0 International
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.



