Das Bohr'sche Atommodell
Download Bohr'sches Atommmodell (PDF, 48 KB)
Download Bohr'sches Atommmodell (DOC, 393 KB)
Download Bohr'sches Atommmodell (ODT, 120 KB)
Download Bohr'sches Atommmodell Lösung (PDF, 41 KB)
Download Bohr'sches Atommmodell Lösung (DOC, 390 KB)
Download Bohr'sches Atommmodell Lösung (ODT, 119 KB)
Haben Sie schon einmal versucht Flammen in verschiedenen Farben zu erzeugen? Sicher haben Sie sich beim Beobachten eines Feuerwerks gefragt, woher die Farben kommen.
Wenn Sie Tafelsalz oder ein anderes Salz, das Natrium enthält, ins Feuer werfen, beobachten Sie eine gelbe Farbe der Flamme. Kupfersalze geben der Flamme ein grünliches Blau. Wenn Sie Flammen durch ein Spektroskop (Gerät zum Auflösen des Lichts in seine verschiedenen Bestandteile) betrachten, erkennen Sie zahlreiche verschiedenfarbige Linien. Diese bilden das Linienspektrum.
Der dänische Physiker Niels Bohr (1885-1962) erklärte dieses Linienspektrum, als er 1913 ein Atom-Modell entwickelte.
Nach der Vorstellung Bohrs umkreisen in Atomen negativ geladene Elektronen den Kern auf verschiedenen Umlaufbahnen mit unterschiedlicher Energie. Bohr verwendete dafür den Ausdruck Energieniveau (oder Elektronenschalen). Bohr sagte, dass die Energie eines Elektrons gequantelt ist, das heißt, Elektronen können dieses oder jenes Energieniveau haben, aber kein Niveau dazwischen.
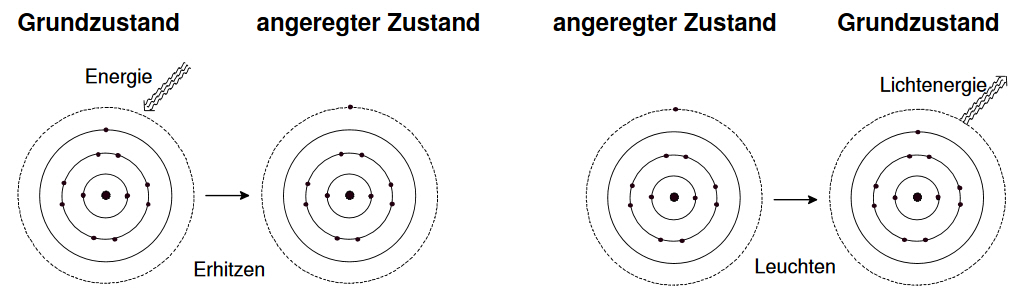
Das Energieniveau, das ein Elektron normalerweise einnimmt, wird sein „Grundzustand“ genannt. Das Elektron kann durch Aufnahme von Energie in einen höheren, weniger stabilen Zustand übergehen. Dies wird angeregter Zustand genannt.
Wenn ein Elektron angeregt ist, kehrt es durch Freigabe der Energie, die es aufgenommen hat wieder in seinen Grundzustand zurück. Manchmal entspricht die von den angeregten Elektronen freigegebene Energie einem Teil des elektromagnetischen Spektrums des sichtbaren Lichts, und der Mensch nimmt dies als farbiges Licht wahr. Kleine Veränderungen im Energiebetrag bedeuten hierbei, dass man verschiedene Farben wahrnimmt.
Aufgaben:
- Erklären Sie die unterschiedlichen Flammenfärbungen beim Erhitzen von Metallsalzen.
- Beschreiben Sie mit eigenen Worten die Entstehung eines Linienspektrums.
- Erläutern Sie die folgende Abbildung:
Kennzeichnung eines Atoms

Nukleonenzahl = Zahl der Protonen + Neutronen
Kernladungszahl = Zahl der Protonen
entspricht der Zahl der Elektronen in der Hülle
Leitsätze nach Bohr
- Elektronen bewegen sich in bestimmten Energiebereichen = Schalen um den Kern ohne Energieabgabe (= strahlungslos).
- Die Schalen haben unterschiedliche Entfernung vom Kern. Sie werden von innen nach außen mit K, L, M, N...bezeichnet.
- Die Elektronen jeder Schale haben einen bestimmten Energiegehalt, der mit wachsender Entfernung vom Kern zunimmt.
- Maximale Besetzung der Schalen:
1. Schale K: 2
2. Schale L: 8
3. Schale M: 18
4. Schale N: 32 - Allgemein gilt: Wenn n = Nummer der Schale (1, 2, 3...), dann ist die maximale Elektronenzahl einer Schale: 2 n2.
- Auf der Außenschale befinden sich maximal 8 Elektronen (=Valenzelektronen).
- Die Besetzung der Schalen erfolgt von innen nach außen.
Beispiele:
12 Mg 14 Si 16 S 19 K K-Schale 2 2 2 2 L-Schale 8 8 8 8 M-Schale 2 4 6 8 N-Schale 1
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


