Gruppenarbeit: Eigenschaften im PSE
Download Gruppenarbeit Eigenschaften im PSE (PDF, 44 KB)
Download Gruppenarbeit Eigenschaften im PSE (DOC, 200 KB)
Download Gruppenarbeit Eigenschaften im PSE (ODT, 80 KB)
Download Gruppenarbeit Eigenschaften im PSE Abbildungen (PDF, 17 KB)
Download Gruppenarbeit Eigenschaften im PSE Abbildungen (DOC, 108 KB)
Download Gruppenarbeit Eigenschaften im PSE Abbildungen (ODT, 26 KB)
Elektronegativität (EN)
Die Elektronegativität kennzeichnet die Fähigkeit eines Atoms, Elektronen in Verbindungen an sich zu ziehen.
Die Kenntnis der EN ist in vielen Fällen ein sehr nützliches Hilfsmittel zur Deutung bzw. Voraussage bestimmter Eigenschaften chemischer Verbindungen oder Reaktionsmechanismen. Sie ermöglicht z. B. eine Abschätzung der chemischen Bindung und der daraus resultierenden Folgen (z. B. Atom- oder Ionenbindung, Einfluss auf die Farbe einer Verbindung).
Es ist leicht einzusehen, dass die EN im Wesentlichen von der Größe der Anziehungskraft abhängt, die der Kern auf die Bindungselektronen ausübt. Innerhalb einer Periode der Hauptgruppen-Elemente nimmt die EN von links nach rechts zu (Edelgasen konnten bis jetzt noch keine EN-Werte zugeordnet werden), da durch die Zunahme der Protonen auch die Kernanziehung auf die äußeren Elektronen der gleichen Schale wächst. Innerhalb einer Hauptgruppe nimmt die Kernladung mit steigender Atommasse ebenfalls zu. Die dadurch stärker werdende Anziehungskraft des Kerns wird aber durch die jeweils größere Entfernung der äußeren Elektronen (neue Schalen) und den abschirmenden Effekt der zwischen dem Kern und den äußeren Elektronen befindlichen Elektronenschalen mehr als ausgeglichen, sodass mit steigender Atommasse die EN innerhalb einer Hauptgruppe abnimmt. Das „elektronegativste“ Element ist Fluor, das „elektropositivste“ Francium.
Die EN zahlenmäßig zu erfassen, ist recht problematisch, da die Art einer chemischen Bindung zwischen zwei Elementen nicht nur von den Eigenschaften der betreffenden ungeladenen Atome abhängt. So beeinflussen u. a. zusätzliche Bindungspartner die äußeren Elektronen und damit die Bindung zu dem anderen Element, sodass man strenggenommen einem Element in verschiedenen Verbindungen auch unterschiedliche EN zuordnen müsste. Eine EN-Skala kann deshalb nur einen vergleichenden Charakter haben. Ihre Zahlenangaben sind Anhaltswerte und hängen von der zugrunde liegenden theoretischen Konzeption und den daraus folgenden Messverfahren ab. Es existieren mehrere solcher Skalen, von denen die gebräuchlichste die von PAULING ist. PAULING wählte einen willkürlichen Nullpunkt und eine EN-Skala mit Werten zwischen 0 und 4.
Aufgaben:
- Formulieren und begründen Sie Regeln, wie sich die EN innerhalb einer Gruppe bzw. einer Periode verändert.
- Nennen und begründen Sie Beispiele von Elementen mit relativ großer EN.
- Erläutern Sie die Bedeutung der EN.
Metallcharakter
Metalle im engeren Sinne nennt man Elemente, die eine Reihe typischer Eigenschaften aufweisen. Sie zeigen einen starken Glanz, leiten elektrischen Strom und Wärme sehr gut, sind plastisch verformbar (durch Walzen, Schmieden usw.) und in festem Zustand lichtundurchlässig. Diese Eigenschaften beruhen im Wesentlichen auf der Fähigkeit der Elemente, leicht Elektronen abgeben zu können. Dies hängt eng mit der lonisierungsenergie der betreffenden Elemente zusammen.
Aus den dort diskutierten Gründen muss der metallische Charakter der Hauptgruppen-Elemente innerhalb einer Gruppe von oben nach unten und innerhalb einer Periode von rechts nach links zunehmen (alle Edelgase sind wegen ihrer stabilen Elektronenbesetzung Nichtmetalle!), sodass die Elemente Francium und Fluor die Extreme innerhalb dieser Klassifikation darstellen. Die Nebengruppen-Elemente, die Lanthanoide und Actinide sind den Metallen zuzurechnen, da sie in der äußersten Schale immer maximal 2 Elektronen besitzen.
Die Anzahl der Nichtmetalle, d. h. der Elemente, die nur schwer Elektronen abgeben oder sogar eine große Elektronegativität aufweisen, ist viel geringer als die der Metalle. Man zählt zu ihnen die Gase H, N, 0, F, CI und die Edelgase, das flüssige Brom und die festen Elemente C, P, S und l. Sie stehen in der rechten Hälfte des Periodensystems (Ausnahme Wasserstoff).
Dass die Aufteilung aller Elemente in Metalle und Nichtmetalle nicht streng durchgeführt werden kann, zeigen die Elemente der 3. bis 6. Hauptgruppe, die die typischen Metalle von den typischen Nichtmetallen trennen. Es sind dies vor allem Antimon, Arsen, Bor, Germanium, Silicium, Astat und Tellur. Sie kommen meist sowohl in metallischen als auch nichtmetallischen Modifikationen vor und können durch Abgabe (Metallcharakter) und durch Aufnahme von Elektronen (Nichtmetallcharakter) Verbindungen eingehen. Sie besitzen geringe elektrische Leitfähigkeit (Halbleiter), die im Gegensatz zu den Metallen in der Schmelze zunimmt. Sie werden wegen dieser Eigenschaften Halbmetalle genannt. Vor allem Silicium und Germanium spielen wegen ihres besonderen Leitfähigkeitsverhaltens in der elektronischen Industrie eine große Rolle.
Aufgaben:
- Formulieren und begründen Sie Regeln, wie sich der Metallcharakter innerhalb einer Gruppe bzw. einer Periode verändert.
- Unterscheiden Sie die Begriffe Metall, Nichtmetall, Halbmetall. Notieren Sie jeweils 4 Beispiele.
Ionisierungsenergie
Der Energiebetrag, der benötigt wird, um das am lockersten gebundene Elektron aus einem einzelnen, gasförmigen Atom, das sich im Grundzustand befindet, zu entfernen, ist die Ionisierungsenergie des Elements.
Bestimmte Atome können durch Aufnahme eines oder mehrerer Elektronen negative Ionen bilden. Die Ausdrücke Ionisierungsenergie und Ionisierungspotential werden ausschließlich auf die Erzeugung positiver Ionen durch Entzug eines Elektrons angewandt. Einige der auf solche Art charakterisierten Ionen treten bei gewöhnlichen chemischen Reaktionen niemals auf (z. B. Ionen der Edelgase oder der Elemente, die normalerweise negative Ionen bilden).
Die Ionisierungsenergie des Heliums (He) ist größer als die des Wasserstoffs, da die Kernladung von He doppelt so hoch ist als die von Wasserstoff und da es sich bei den abgegebenen Elektronen in beiden Fällen um Elektronen der ersten Elektronenwolke handelt. Im Gegensatz dazu ist die Ionisierungsenergie des Lithiums (Li) sehr viel kleiner als die des He, obwohl Li eine höhere Kernladung als He besitzt. Beim He wird das eine Elektron durch das andere nicht wirksam abgeschirmt, da sie beide die gleiche Elektronenwolke besetzen. Das Li-Atom ist nicht nur größer als das He-Atom, beim Li schirmen die beiden Elektronen der ersten Schale die Kernladung auch von dem bei der Ionisierung entfernten Elektron aus der zweiten Schale stark ab.
Folgt man der zweiten Periode vom Li zum Neon, so erhöht sich die Kernladung von +3 auf +10. Da die Elektronen in dasselbe äußere Niveau eingebaut werden, erhöhen sie den Abschirmungseffekt nicht wesentlich; die Folge ist eine Zunahme der Ionisierungsenergie. Die Ionisierungsenergie von Neon ist jedoch niedriger als von He. Ganz allgemein nimmt das Ionisierungspotential innerhalb einer Gruppe ab. Hohe Ionisierungsenergien der Edelgase sind ein Hinweis für die große Stabilität dieser Elektronenkonfigurationen. Es ist äußerst schwierig, ein Elektron aus diesen „geschlossenen“ Systemen (= voll besetzte Außenschale) zu entfernen. Die Elemente Be, Mg, Zn, Cd und Hg (gefüllte Unterschalen) besitzen hohe Ionisierungsenergien, im Vergleich zu denen der Elemente, die ihnen in der gleichen Periode folgen.
Aufgaben:
- Formulieren und begründen Sie Regeln, wie sich die Ionisierungsenergie innerhalb einer Gruppe bzw. einer Periode verändert.
- Nennen und begründen Sie je 2 Beispiele von Elementen mit einer relativ großen bzw. kleinen Ionisierungsenergie.
- Begründen Sie, warum aus der Ionisierungsenergie Schlüsse über die Stabilität von Elektronenkonfigurationen gezogen werden können.
Atomradius
Die Bestimmung der Atomgrößen wirft ein Problem auf. Betrachtet man das Atom als Kugel, so sollte sein Radius die Entfernung vom Kernmittelpunkt zum äußeren Orbitalbereich des - vom Kern aus gesehen - letzten Elektrons sein. Die Elektronenwolke eines Atoms jedoch ist von wechselnder Intensität und die Wahrscheinlichkeit, ein Elektron aufzufinden, erstreckt sich bis ins Unendliche. Es ist unmöglich, ein einzelnes Atom zu isolieren und auszumessen. Am wirkungsvollsten hat sich die Methode zur Bestimmung der sogenannten Atom- oder Kovalenzradien erwiesen. Man kann die Entfernung zwischen den Kernen zweier kovalent gebundener Atome (d. h. über eine Atombindung) durch Röntgenbeugung oder spektroskopische Methoden bestimmen. Diese Bindungslänge wird dann zwischen den gebundenen Atomen unter Berücksichtigung ihres Bindungsanteils aufgeteilt, um zu einem Wert für die Atomradien zu kommen. Beispielsweise erhält man für das Chloratom einen Radius von 99 pm, indem man die Entfernung zwischen den beiden Chlorkernen in der Cl—Cl-Bindung 198 pm durch zwei teilt.
Dieses Verfahren kann auch umgekehrt werden; der Atomradius von Chlor 99 pm kann von der Bindungslänge der C—Cl-Bindung 176 pm abgezogen werden, um so den Atomradius von Kohlenstoff 77 pm zu erhalten.
Ändert man die Umgebung eines Atoms, so kann sich seine tatsächliche Größe ändern. Daher treten bisweilen Diskrepanzen auf, wenn diese Methode der Zuordnung von Atomradien benutzt wird. Trotzdem sind diese Daten nützlich, weil sie Tendenzen aufzeigen und Verallgemeinerungen erlauben.
Innerhalb einer Gruppe des PSE nimmt der Atomradius von oben nach unten zu, da die größeren Atome einer Gruppe mehr Elektronenschalen besitzen als die kleineren. Ebenso allgemein nimmt der Atomradius innerhalb einer Periode von links nach rechts ab. Die äußeren Elektronen von Elementen einer gegebenen Periode haben alle dasselbe Hauptenergieniveau. Mit steigender Ordnungszahl wird innerhalb einer Periode das neu hinzukommende Elektron in dieselbe oder eine innere Schale eingebaut. Dabei ist es wichtig, sich klarzumachen, dass die Protonenzahl im Kern ebenfalls erhöht wird. Dieser Anstieg positiver Ladung im Kern zeigt die Tendenz, die Elektronenhülle in den Kern hineinzuziehen, was eine Verminderung der Atomgröße zur Folge hat.
Aufgaben:
- Formulieren und begründen Sie Regeln, wie sich der Atomradius innerhalb einer Gruppe bzw. einer Periode verändert.
- Nennen und begründen Sie je 2 Beispiele von Elementen mit relativ großen bzw. kleinen Atomradien.
- Markieren Sie in Abb. 1 die beiden Hauptgruppen: Alkalimetalle (z. B. rot) und Halogene (z. B. gelb); markieren Sie ebenso die erste Periode!
Abbildungen
1 ____________________________
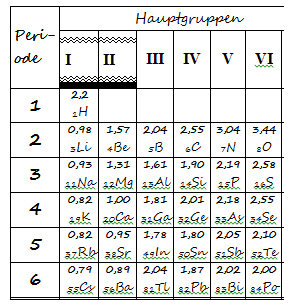
2 ____________________________
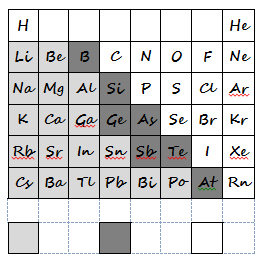
3 ____________________________________________________
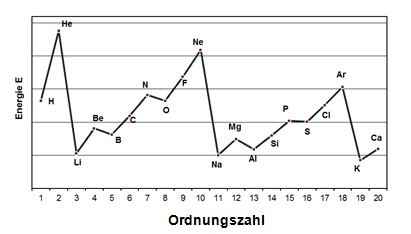
4 ____________________________________________________
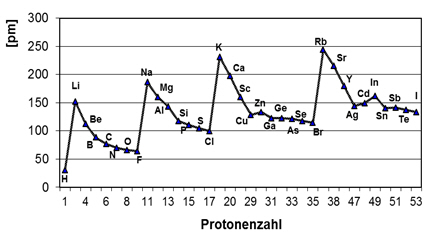
Wie verändern sich die folgenden periodischen Eigenschaften innerhalb des Periodensystems?
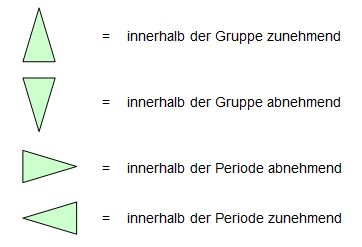
Zeichnen Sie die entsprechenden Symbole in die folgende Tabelle ein!
Eigenschaften |
Veränderung innerhalb des PSE |
1. Atomradius |
|
2. Ionisierungsenergie |
|
3. Elektronegativität |
|
4. Metallcharakter |
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


