Van-der-Waals-Kräfte
Download van-der-Waals (PDF, 44 KB)
Download van-der-Waals (DOC, 200 KB)
Download van-der-Waals (ODT, 80 KB)
Van-der-Waals-Kräfte sind zwischenmolekulare Kräfte, die zwischen Atomen bzw. Molekülen auftreten. Sie entstehen dadurch, dass Atome äußerst kurzlebige Dipole bilden können. Die eine Seite des Atoms weist dann eine etwas stärker negative Ladung auf als die andere (unsymmetrische Ladungsverteilung).
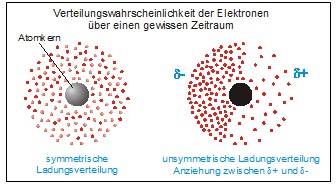
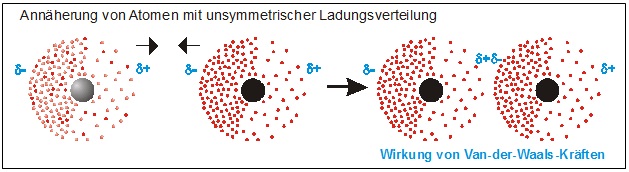
Nähern sich Atome und erfolgt in beiden Atomen die Ladungsverschiebung synchron, dann wirken ab einem bestimmten Abstand Anziehungskräfte, die als Van-der-Waals-Kräfte bezeichnet werden. Der positiv polarisierte Teil des einen Atoms zieht dabei den negativ polarisierten Teil des anderen Atoms an.
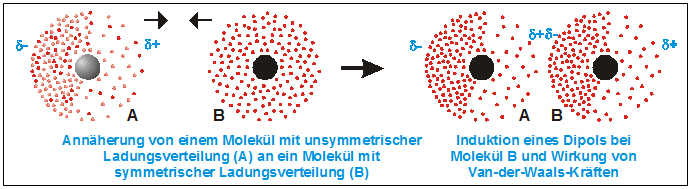
Besitzt zur Zeit der Annäherung nur ein Atom eine Ladungsverschiebung (Dipol), so kann es bei dem anderen Atom eine Ladungsverschiebung induzieren, so dass wiederum der positiv polarisierte Teil des einen Atoms den negativ polarisierten Teil des anderen Atoms anzieht.
Die Möglichkeit zur Polarisierung nimmt mit steigender Oberfläche des Atoms zu und ist umso größer, je weiter die äußeren Elektronen vom Kern entfernt sind. Aus diesem Grund nehmen die Van-der-Waals-Kräfte mit steigender Elektronenzahl, also auch mit steigender Atom- bzw. Molekülmasse zu.
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


