Elektronenpaar-Abstoßungsmodell
Download EPA (PDF, 44 KB)
Download EPA (DOC, 200 KB)
Download EPA (ODT, 80 KB)
Download EPA, Lösung (PDF, 17 KB)
Download EPA, Lösung (DOC, 108 KB)
Download EPA, Lösung (ODT, 26 KB)
Die räumliche Gestalt von Molekülen
Das sogenannte Elektronenpaar-Abstoßungsmodell (EPA-Modell) erklärt die räumliche Gestalt von Molekülen. Es geht davon aus, dass
- sich Elektronenpaare abstoßen und deshalb so weit wie möglich voneinander entfernt anordnen.
- neben den Bindungselektronenpaaren auch die freien Elektronenpaare eine wesentliche Rolle für den Bau des Moleküls spielen.
- freie Elektronenpaare mehr Raum beanspruchen, da sie nur von einem Atomkern angezogen werden.
- Mehrfachbindungen wie Einfachbindungen behandelt werden.
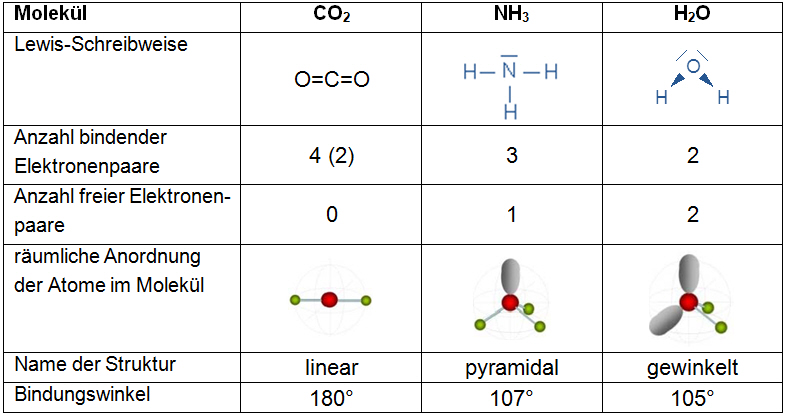
Beispiel

Bindungswinkel: Winkel zwischen zwei Atombindungen.
Arbeitsauftrag
- Geben Sie die Lewis-Schreibweise, die Anzahl der bindenden und freien Elektronenpaare an.
- Erarbeiten Sie sich die räumliche Struktur der Moleküle CO2, NH3 und H2O. Beachten Sie dabei die Aussagen des EPA-Modells. Als Hilfe dient Ihnen teilweise auch der Modellbaukasten.
Den Namen der Struktur und den Bindungswinkel besprechen wir gemeinsam. - Tragen Sie Ihre Ergebnisse auf der Folie ein. Füllen Sie die unten stehende Tabelle erst nach der Besprechung aus.
Der Text dieser Seite ist verfügbar unter der Lizenz CC BY 4.0 International
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


