Übungen: Bindungsarten
Download Übungen Bindungsarten (PDF, 44 KB)
Download Übungen Bindungsarten (DOC, 200 KB)
Download Übungen Bindungsarten (ODT, 80 KB)
Download Übungen Bindungsarten, Lösung (PDF, 17 KB)
Download Übungen Bindungsarten, Lösung (DOC, 108 KB)
Download Übungen Bindungsarten, Lösung (ODT, 26 KB)
- Geben Sie für folgende Verbindungen die beteiligten Ionen und die entsprechende Verhältnisformel an:
a) Magnesiumnitrid Mg3 N2 b) Magnesiumchlorid Mg Cl2 c) Natriumsulfid Na2 S d) Calciumnitrid Ca3 N2 e) Kaliumsulfat (SO42-) K2SO4 f) Aluminiumfluorid AlF3 - Ordnen Sie die Schmelztemperaturen : a) 730 °C, b) 772 °C, c) 575 °C, d) 1392 °C
dem Fluorid, Chlorid, Bromid und Iodid des Calciums zu.
a) 730 °C Ca-Bromid
b) 772 °C Ca-Chlorid
c) 575 °C Ca-Iodid ➔ größtes Ion ➔ großer Abstand zwischen den Atomkernen
d) 1392 °C Ca-Fluorid ➔ kleinstes Ion
- Erklären Sie die unterschiedlichen Atom- und Ionenradien (in pm = 10-12 m):
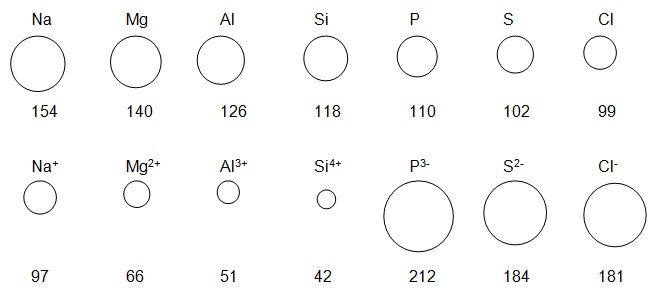
r (Kation) < r (Atom) ➔ Abgabe von e- ➔ 1 Schale weniger ➔ Radius kleiner
R (Anion) > r (Atom) ➔ Aufnahme von e- ➔ Anziehung Kern – e- sinkt und e- stoßen sich gegenseitig ab ➔ Radius größer - Erklären Sie die schlechte Wasserlöslichkeit von Calciumsulfat.
Gitterenergie viel größer als die Hydratationsenergie - Interpretieren Sie die Kurve.
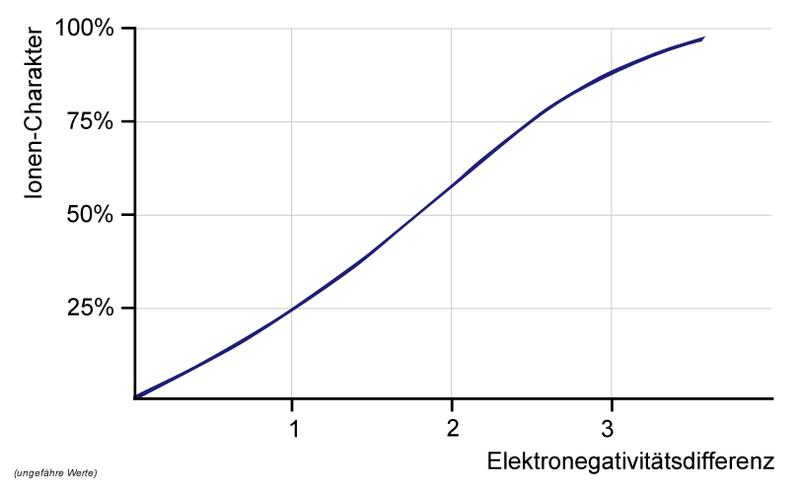
ΔEN ganz klein, Partner gleichberechtigt ➔ unpolare AB,
Zunahme der ΔEN ➔ Polarität steigt ➔ Bindungselektronenpaar wird immer weiter zu einem Partner gezogen.
Ist die ΔEN sehr groß, so zieht ein Partner ein Elektron so weit an, dass es ganz zum Partner übergeht ➔ Ionenbindung
- Geben Sie an, welche Bindungsart bei den folgenden Verbindungen vorliegt:
a) CO2 polar Atombindung 1 b) HF Ionenbindung 1,9 c) H2 unpolar Atombindung 0 d) NaF Ionenbindung 3,1 e) SO4 polar Atombindung 1 f) H2O polar Atombindung 1,4 g) CH4 unpolar Atombindung 0,3 h) K2O Ionenbindung 2,7 i) N2 unpolar Atombindung 0 j) NH3 polar Atombindung 0,9 - Geben Sie für die folgenden Verbindungen die Strukturformel und die nach dem EPA-Modell zu erwartende räumliche Anordnung an.
a) PCl3 Tetraeder
b) C2H4 linear
c) C2H2 linear
d) H2S Tetraeder
Der Text dieser Seite ist verfügbar unter der Lizenz CC BY 4.0 International
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.


