Hinweise und LösungenStation 1: Anorganischer Katalysator und Biokatalysator "Katalase"
Auswertung: Der anorganische Katalysator Braunstein beschleunigt die Zersetzung von H2O2, wobei Sauerstoff entsteht. In Kartoffeln und Trockenhefe ist der Biokatalysator Katalase enthalten, der ebenfalls die Zersetzung von H2O2 beschleunigt. Der frisch gepresste Kartoffelbrei hat eine viel größere Oberfläche als das Kartoffelstückchen, daher die stärkere Enzymwirkung. Zu Frage 2: 2 H2O2 Zu Frage 3.: Energiediagramm einer exothermen Reaktion ohne und mit Enzym. Deutung der Enzymwirkung: Erniedrigung der Aktivierungsenergie durch anderen Reaktionsverlauf, Enzym-Substrat-Komplex. Hinweis: Das Zellgift Wasserstoffperoxid entsteht im Zellstoffwechsel z.B. durch unvollständige Elektronenübertragung auf Sauerstoff. Bei vollständiger Elektronenübertragung auf Sauerstoff entsteht Wasser.
Die Katalasen verhindern durch die Zersetzung von H2O2 die Schädigung von Zellstrukturen. Station 2: Die pH-Abhängigkeit der EnzymwirkungBeob.:
Auswertung: Deutung der Ergebnisse mittels Schlüssel-Schloss-Prinzip. Bei zu niedrigem bzw. zu hohem pH-Wert wird die Tertiärstruktur des Enzyms verändert. Es kommt zu Protonenanlagerungen oder –abspaltungen an den funktionellen Gruppen –COO- und –NH3+ der Aminosäurereste. Dadurch verändern sich die innermolekularen Wechselwirkungen zwischen Aminosäureresten des Proteinmoleküls und somit dessen Struktur. Zusatzaufgabe: Substratspezifität der Urease
Weshalb verliert Pepsin im Dünndarm seine katalytische Aktivität? Veränderter pH-Wert führt zu Strukturveränderungen in der tert. Struktur des Enzyms. Station 3: Die Temperaturabhängigkeit der Enzymwirkung
Auswertung: Katalase wird durch Kochen denaturiert, d.h. die Eiweißstruktur wird durch Überwinden von innermolekularen Anziehungskräften (Van-der-Waals’Kräfte, Wasserstoffbrücken, Disulfidbrücken) irreversibel verändert. Zusatzaufgabe: 37 °C, RGT-Regel. Deutung der Grafik:
Station 4: Substratspezifität der Urease
Auswertung: Deutung der Ergebnisse mithilfe des Schlüssel-Schloss-Prinzips. Im Unterschied zu einem Harnstoffmolekül ist im N-Methylharnstoffmolekül ein H-Atom durch eine viel größere Methyl-Gruppe ersetzt. Daher passt N-Methylharnstoff nicht so gut ins aktive Zentrum der Urease wie Harnstoff. Hinweis: Nach der Gefahrstoffverordnung ist der Versuch auch mit Thioharnstoff erlaubt, es wird aber auf eine Ersatzstoffprüfung hingewiesen. Der Ersatzstoff N-Methylharnstoff ist mit dem Gefahrensymbol Xn gekennzeichnet, Thioharnstoff mit Xn und N. N bedeutet umweltschädlich, hier: Giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkung haben. Lösungen mit w (Thioharnstoff) < 10 % müssen nicht mit einem Gefahrensymbol gekennzeichnet werden! Station 5: Substrathemmung der Urease
Auswertung: Die Ureaseaktivität ist in 50 %-iger Harnstofflösung deutlich geringer als in 2 %-iger. Bei zu hoher Substratkonzentration wird das Enzym offensichtlich gehemmt. Hinweis: Jedes Harnstoffmolekül hat im aktiven Zentrum der Urease offenbar mehr als eine Bindungsstelle. Bei zu hoher Harnstoffkonzentration konkurrieren mehrere Harnstoffmoleküle um das aktive Zentrum und behindern sich gegenseitig. Deshalb nimmt die Aktivität des Enzyms mit zunehmender Substratkonzentration zunächst zu, durchläuft ein Maximum und fällt dann wieder ab à Substrathemmung. Station 6: Kompetitive Hemmung der Urease
Auswertung: Die Moleküle von Harnstoff und N-Methylharnstoff sind ähnlich gebaut. Im RG 3 konkurrieren diese ähnlich gebauten Moleküle um das aktive Zentrum des Enzyms. Pro Zeiteinheit können folglich weniger Harnstoffmoleküle gespalten werden. Hinweis: Ähnlich gebaut sind Harnstoff, Thioharnstoff, N-Methylharnstoff und N,N-Dimethylharnstoff. Die kompetitive Hemmung ist für die Arzneimittelindustrie wichtig. Beispielsweise ist Atropin, das Gift der Tollkirsche, kompetitiver Hemmer der Acetylcholinesterase; es hat strukturelle Ähnlichkeiten mit deren Substrat, dem Acetylcholin. Es vermag die extreme Giftwirkung von Phosphorsäureestern wie E-605 zu mindern. Station 7: Vergiftung der Urease durch Schwermetallsalze
Auswertung: Die Enzymaktivität von Urease wird durch Schwermetall-Ionen blockiert. Deutung mithilfe des Schlüssel-Schloss-Prinzips. Änderung der Tertiärstruktur durch ionische Wechselwirkungen z.B. zwischen Cu2+ und –COO—Gruppen der Aminosäurereste. Hinweis: Auf die Enzyme wirken aus dem Milieu heraus aktivierende und hemmende Stoffe ein. Stoffe , welche die Reaktionsgeschwindigkeit der enzymatischen Katalyse verringern, sind Hemmstoffe oder Inhibitoren. Wenn der Hemm-Mechanismus zu irreversiblen Veränderungen führt, spricht man von Giften.Die Übergänge zwischen Hemmung und Vergiftung sind aber fließend. Angriffspunkte für Inhibitoren können alle biochemisch relevanten Moleküle sein: Nucleinsäuren, Enzyme und deren Coenzyme sowie die Substrate. Bei Urease zeigen vor allem die komplexbildenden Schwermetall-Ionen wie Cu2+ und Ni2+ Giftwirkung. Blei-Ionen (Pb2+) sind für Urease dagegen kein Gift. Station 8: Gegenmaßnahmen bei Schwermetallvergiftungen
Auswertung: In RG 2 bleibt die Urease dauerhaft durch Cu2+ vergiftet. Die Aminosäure Cystein sowie EDTA sind in der Lage die Cu2+-Ionen aus der vergifteten Urease herauszuholen und die Enzymaktivität wieder herzustellen. Hinweis: Schwermetallvergiftungen von Enzymen sind oftmals reversibel, wenn man Komplexbildner wie EDTA oder die Aminosäure Cystein hinzufügt. Sie können die Schwermetall-Ionen durch Ausbildung von Chelat-komplexen stärker an sich binden als die Enzyme. Dies ist für medizinische Zwecke von großer Wichtigkeit. Allerdings ist eine Behandlung von Patienten mit Schwermetallvergiftung mit solchen Komplexbildnern nicht unproblematisch, da dem Körper dabei auch wichtige Mineralien wie Mg2+ entzogen werden. Station 9a: Enzymatischer Abbau von Harnstoff
Auswertung: Zunahme der Ionenkonzentrationen. RGT-Regel. Versuch 9b: Enzymatischer Abbau von HarnstoffBeob.: Innerhalb weniger Minuten nimmt der pH-Wert von < 6 bis 9 zu. Auswertung: Beim Harnstoffabbau entsteht Ammoniak, dessen wässrige Lösung alkalisch reagiert. Mit zunehmender NH3-Konzentration steigt anfangs auch die OH-- Konzentration und damit der pH-Wert. Diskussion der Frage, weshalb der pH-Wert nach wenigen Minuten bei ca. 9 konstant bleibt. Station 10: Was haben Enzyme mit Käse zu tun?Beob.:
Auswertung: Chymosin wird durch Kochen denaturiert, d.h. die Eiweißstruktur wird durch Überwinden von innermolekularen Anziehungskräften (Van-der-Waals’Kräfte, Wasserstoffbrücken, Disulfidbrücken) irreversibel verändert. à Keine Enzymaktivität mehr, Schlüssel-Schloss-Prinzip. Zu 3.: Chymosin ist eine Proteinase mit hoher Substratspezifität. Bei der H-Milch wurde ein Teil des löslichen Caseins durch das Erhitzen in seiner Raumstruktur so verändert, dass es zwar ausfällt, aber vom Chymosin nicht mehr als Substrat erkannt wird. |
Informationen und Materialien zum Fach Biologie in allen Schulformen und für alle Schulstufen



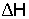 < 0
< 0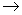 2 H2O
2 H2O