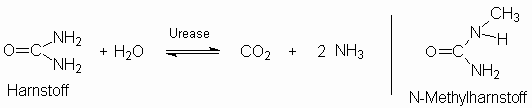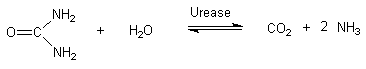Station 7:
Vergiftung der Urease durch Schwermetallsalze
Grundlagen:
Urease kommt in vielen Pflanzen,
Schimmelpilzen und Bodenbakterien vor. Der
Ammoniak-geruch von Gülle hat seinen Grund im
bakteriellen, enzymatischen Harnstoffabbau nach
folgenden Reaktionen:
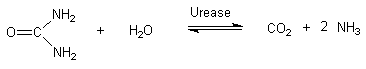
CO2 + 2 NH3
+ 2 H2O
 2
NH4+ + HCO3-
+ OH- 2
NH4+ + HCO3-
+ OH-
Aufgaben:
- Führen Sie den Versuch durch und
protokollieren Sie die Beobachtungen.
- Was schließen Sie aus den
Versuchsergebnissen?
- Stellen Sie Ihre Ergebnisse und
Erkenntnisse dem Plenum vor.
Materialien:
10 Reagenzgläser (RG),
RG-Ständer, Lösungen in Tropfflaschen,
Harnstoff-Lösung (w = 2 %),
Schwermetallsalz-Lösungen (c = 0,1 mol/l) von
z.B. Kupfersulfat,
Zink(II)-sulfat usw., Kochsalzlösung (c = 0,1
mol/l), Phenolphthalein-Lösung,
Urease-Suspension (w = 0,1 %).
Zur Herstellung von 100 ml
Salzlösung (c = 0,1 mol/l) benötigt man:
- 2,50 g CuSO4 �
5 H2O [Xn, N]
- 2,37 g NiCl2 �
6 H2O [T]
- 2,88 g ZnSO4 �
7 H2O [Xi, N]
- 0,58 g NaCl
Durchführung:
Bereiten Sie 5 RG vor:
- RG 1: Ca. 1 ml (halbe
Daumenbreite) Urease-Suspension
- RG 2: Ca. 1 ml
Urease-Suspension + 3 Tr.
Kupfersalzlösung
- RG 4: Ca. 1 ml
Urease-Suspension + 3 Tr. Zinksalzlösung
- RG 5: Ca. 1 ml
Urease-Suspension + 3 Tr. Kochsalzlösung
Lassen Sie die
Salzlösungen
2-3 min lang einwirken!
Während
dieser Einwirkzeit
bereiten Sie 5 weitere RG mit je 2 ml
Harnstofflösung (eine Daumenbreite) und 2 Tr.
Phenolphthalein vor.
Danach gießen Sie die
Harnstofflösungen zu
den Urease-Suspensionen und schütteln kurz um.
Station 8:
Gegenmaßnahmen bei
Schwermetallvergiftungen
Grundlagen:
Urease kommt in vielen Pflanzen,
Schimmelpilzen und Bodenbakterien vor.
Der Ammoniak-geruch von Gülle hat seinen
Grund im bakteriellen, enzymatischen
Harnstoffabbau nach folgenden Reaktionen:
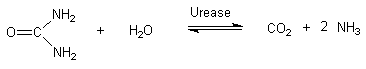
CO2 + 2 NH3
+ 2
H2O 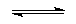 2 NH4+
+ HCO3- + OH- 2 NH4+
+ HCO3- + OH-
Aufgaben:
- Führen Sie den Versuch durch und
protokollieren Sie die
Beobachtungen.
- Was schließen Sie aus den
Versuchsergebnissen?
- Stellen Sie Ihre Ergebnisse und
Erkenntnisse dem Plenum vor.
Materialien:
8 Reagenzgläser (RG),
RG-Ständer,
Lösungen in Tropfflaschen,
Harnstofflösung (w = 5 %),
Kupfer(II)-sulfatlösung (c = 0,01
mol/l), Phenolphthalein-Lösung,
EDTA-Lösung (c = 0,1 mol/l,
Dinatriumsalz), Cystein-Lösung (c = 0,1
mol/L), Urease-Suspension (w = 0,1 %).
Zur Herstellung von 100 mL Lösung
mit
oben angegebener Konzentration benötigt
man:
- 0,25 g CuSO4 � 5 H2O
[Xn, N]
- 3,72 g EDTA-Dinatriumsalz
- 1,21 g Cystein
Durchführung:
Bereiten Sie 4 RG vor:
- RG 1: Ca. 1 ml (halbe
Daumenbreite) Urease-Suspension .
- RG 2: Ca. 1 ml Urease-Suspension
+ 3 Tr. Kupfer(II)-sulfatlösung.
- RG 3: Ca. 1 ml Urease-Suspension
+ 3 Tr. Kupfer(II)-sulfatlösung.
- RG 4: Ca. 1 ml Urease-Suspension
+ 3 Tr. Kupfer(II)-sulfatlösung.
Lassen Sie die
Kupfer(II)-sulfatlösungen 2-3 min lang
einwirken!
Während dieser Einwirkzeit werden 4
weitere RG vorbereitet:
- RG 1’: Ca. 2 ml (eine
Daumenbreite) Harnstofflösung +
3 Tr. Phenolphthalein + 1 mL H2O.
- RG 2’: wie RG 1’.
- RG 3’: Ca. 2 mL
Harnstofflösung + 3 Tr.
Phenolphthalein + 1 ml
EDTA-Lösung.
- RG 4’: Ca. 2 mL
Harnstofflösung + 3 Tr.
Phenolphthalein + 1 ml
Cysteinlösung.
Dann gießen Sie die
Harnstofflösungen zu den
Urease-Suspensionen (RG 1’ à
RG 1, RG
2’à
RG 2, usw.).
Notieren Sie die Beobachtungen nach 5,
15 und 30 Minuten. (Nehmen Sie den
RG-Ständer der Station 8 für die
weitere Beobachtung zur nächsten Station
mit).
Station 9 a:
Enzymatischer Abbau von
Harnstoff
Messwerterfassung mit dem
Computer
Grundlagen:
Urease kommt in vielen
Pflanzen, Schimmelpilzen und
Bodenbakterien vor. Der
Ammoniakgeruch von Gülle hat
seinen Grund im bakteriellen,
enzymatischen Harnstoffabbau nach
folgenden Reaktionen:
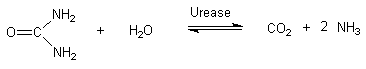
CO2 + 2 NH3 + 2 H2O 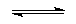 2 NH4+ + HCO3- + OH- 2 NH4+ + HCO3- + OH-
Der Verlauf des
Harnstoffabbaus kann durch die
Veränderung der elektrischen
Leitfähigkeit der Lösung
verfolgt werden.
Aufgaben:
- Führen Sie den Versuch
durch und protokollieren
Sie die Beobachtungen.
- Was schließen Sie aus
den Versuchsergebnissen?
- Stellen Sie Ihre
Ergebnisse und
Erkenntnisse dem Plenum
vor.
Materialien:
20-ml-Schnappdeckelglas,
Rührfisch, Magnetstab,
Stativmaterial, Magnetrührer,
Leitfähigkeitsmesszelle,
Messwandler (z.B.
ALL-CHEM-MISST), Computer mit
geeigneter Software (z.B.
Uni-Mess-Light vom
"AK-Computer"),
Drucker, 2-ml- und 10-ml-Pipette,
Pipettierhilfe, 100-ml-Becherglas
(zum Spülen der Messzelle).
Bei Messung der
Temperaturabhängigkeit der
Enzymaktivität (siehe Hinweis):
Kristallisierschale für
Wasserbad, Kontaktthermometer.
Harnstoff-Lösung (w = 2 %),
Urease-Suspension (w = 0,1 %),
dest. Wasser.
Versuchsaufbau:
PC und
Leitfähigkeitsmessfühler mit
Meßwandler verbinden.
Messfühler so an einem Stativ
befestigen, dass die Elektroden
vollständig in die vorgelegten
Lösungen eintauchen.
Voreinstellungen am
ALL-CHEM-MISST:
- Leitfähigkeitsmesszelle
anschließen und
Messbereich 200 �S und
PC einstellen
- Messgröße:
Leitfähigkeit
- Wandler / Kanal: ACM L 2
mS
- Darstellung: Grafik- und
Digitalanzeige
- X-Achse: Zeit,
Zeitintervall: 1 s,
x-Bereichsobergrenze: 300
s
- Y-Achse: Leitwert,
Einheit: mS
- Y-Bereichsobergrenze: 2
- Y-Nachkommastellen: 3
Durchführung:
- Pipettieren Sie 10 mL
Harnstofflösung in das
Schnappdeckelglas mit
Rührfisch.
- Schalten Sie dann den
Magnetrührer ein und
prüfen die
Leitfähigkeit mit dem
Leitfähigkeitsprüfer.
Der Computer zeigt die
Leitfähigkeit digital in
mS (Millisiemens) an.
- Wenn die Leitfähigkeit
konstant bleibt, geben
Sie 2 mL
Urease-Suspension zu und
klicken mit der Maustaste
das grüne Feld
"Start" an.
- Die Änderung der
Leitfähigkeit wird
sowohl grafisch in einem
Diagramm als auch digital
auf dem Monitor
aufgezeichnet. Klicken
Sie nach Ablauf der
Messzeit von 300 s mit
der Maustaste das Feld
"beenden" an.
- Daten speichern
- Falls Ausdruck
gewünscht: à
Extras (UNI-AUS mit
Werten starten) à
Daten aus der
Zwischenablage anklicken à
"Werte aus der
Zwischenablage
geholt" à
OK à
Druckersymbol
- Gehen Sie mit der
Maustaste auf die
Symbolleiste und klicken
Sie unter
"Messen"
"Messreihe
aufnehmen" an.
- Spülen Sie die
Leitfähigkeitsmesszelle
mit dest. Wasser, damit
sie für den nächsten
Versuch einsatzbereit
ist.
Hinweis:
Der Versuch kann bei
verschiedenen Temperaturen (40
°C, 60 °C, 80 °C, 100 °C)
wiederholt werden.
Station 9b:
Enzymatischer Abbau
von Harnstoff
Grundlagen:
Urease kommt in vielen
Pflanzen, Schimmelpilzen
und Bodenbakterien vor.
Der Ammoniak-geruch von
Gülle hat seinen Grund
im bakteriellen,
enzymatischen
Harnstoffabbau nach
folgenden Reaktionen:
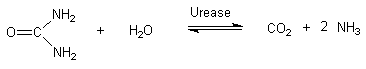
CO2 + 2 NH3 + 2 H2O  2
NH4+ + HCO3- + OH- 2
NH4+ + HCO3- + OH-
Der Verlauf des
Harnstoffabbaus kann
durch die Veränderung
des pH-Wertes der Lösung
verfolgt werden.
Aufgaben:
- Führen Sie den
Versuch durch und
protokollieren Sie die
Beobachtungen.
- Was schließen Sie
aus den
Versuchsergebnissen?
- Stellen Sie Ihre
Ergebnisse und
Erkenntnisse dem Plenum
vor.
Materialien:
20-ml-Schnappdeckelglas,
Rührfisch, Magnetstab,
Stativmaterial,
Magnetrührer,
Stativmaterial, pH-Meter,
2-ml- und 10-ml-Pipette,
Pipettierhilfe, Stoppuhr
oder Armbanduhr,
Harnstoff- Lösung (w = 2
%), Urease-Suspension (w
= 0,1 %), dest. Wasser,
Pufferlösungen zum
Eichen des pH-Meters.
Durchführung:
|
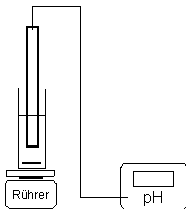 |
- Pipettieren
Sie 10 mL
Harnstofflösung in das
Glasgefäß mit
Rührfisch.
- Schalten
Sie den Magnetrührer ein
und protokollieren Sie
vor der Zugabe der
Urease-Suspension den
pH-Wert der Lösung à
Wertetabelle: pH bei t =
0.
- Nach
Zugabe von 2 mL
Urease-Suspension starten
Sie die Stoppuhr.
- Protokollieren
Sie alle 10 s den
pH-Wert. Gesamtzeit: 3-4
min.
- Lassen
Sie nach dem Spülen die
pH-Elektrode im dest.
Wasser stehen, damit sie
für den nächsten
Versuch einsatzbereit
bleibt. pH-Meter
bitte nicht ausschalten!
|
|
Zeit t in s
|
0
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
100
|
110
|
120
|
|
pH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zeit t in s
|
130 |
140
|
150
|
160
|
170
|
180
|
190
|
200
|
210
|
220
|
230
|
240
|
250
|
|
pH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|