ProteoPur
(Chromatographische Reinigung und gelelektrophoretische Analyse eines rekombinanten Proteins)
Die Expression,
Reinigung und Charakterisierung rekombinanter Proteine ist ein wichtiges
Verfahren sowohl in der Grundlagenforschung als auch in der angewandten
Forschung. Mit Hilfe dieses Kits können Sie ein rekombinant in E. coli
erzeugtes Protein durch ein chromatografisches Verfahren reinigen. Die einzelnen
Reinigungsschritte werden durch diskontinuierliche Polyacrylamid-Gelektrophorese
(kurz Disk PAGE) überprüft und die Ausbeute des gereinigten Proteins
photometrisch bestimmt.
Das Protein, das Sie aus einem E. coli Proteinextrakt reinigen
werden, ist das Enzym Glutathion-S-Transferase (kurz GST). Dieses
Protein, das in vielen Eukaryoten vorkommt, ist aus zwei identischen
Untereinheiten aufgebaut. Man bezeichnet es auch als "Homodimer". Jede der
beiden Untereinheiten besteht aus ca. 230 Aminosäuren, was einem
Molekulargewicht des Proteins von ca. 52 kDa entspricht (Eine Aminosäure hat ein
durchschnittliches Molekulargewicht von 110 Da; Dalton steht für die
Atommasseneinheit). Die natürliche Funktion des Proteins ist die Übertragung
eines Moleküls reduzierten Glutathions (kurz GSH) auf andere Moleküle, die
dadurch aus der Zelle ausgeschleust werden können, um diese vor Vergiftung zu
schützen.
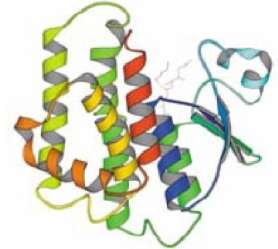 |
Abb.1: 3D Struktur der Glutathion-S-Transferase (GST) Gezeigt sind beide Untereinheiten mit b-Faltblatt Strukturen (gebänderte Pfeile), a-Helix Strukturen (verdrillt) und unstrukturierten Bereichen. |
Das Gen, welches dieses Enzym kodiert, wurde mit Hilfe gentechnischer Verfahren mit einem Expressionsvektor verknüpft (Abb.2). Nach Transformation von E. coli Zellen mit diesem Vektor produzieren diese das rekombinante Protein in großen Mengen. Große Mengen dieser Bakterien kann man in einem Fermenter züchten und nach Ernte durch geeignete Verfahren, wie z. B. Hochdruck oder Ultraschallbehandlung, aufschließen, um das gewünschte Protein aus dem Gesamtproteinextrakt von E. coli zu gewinnen.
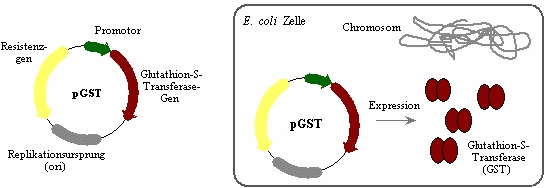
Abb.2:
Erste Abbildung: Funktionselemente des Expressionsplasmids pGST. Das Plasmid trägt einen
Promotor, von dem aus das GST-Gen in m-RNA transkribiert wird. Der
Replikationsursprung (origin of replication, kurz ori), bewirkt die stabile
Replikation des Plasmids unabhängig vom E. coli Chromosom. Das Resistenzgen
verleiht der Zelle eine Resistenz gegen das Antibiotikum Ampicillin. Ein
permanenter Selektionsdruck verhindert den Verlust des Plasmids. Die Pfeile
geben die Richtung der Transkription an.
Zweite Abbildung: Das Protein Glutathion-S-Transferase wird in E. coli Zellen, die das
Expressionsplasmid pGST tragen, in großen Mengen produziert
Mit Hilfe gentechnischer Verfahren erzeugte Proteine werden durch chromatographische Verfahren voneinander getrennt und dadurch gereinigt. Dabei macht man sich entweder deren unterschiedliche physikalisch-chemische Eigenschaften wie Ladung, Größe, Hydrophobizität oder auch deren Interaktion mit bestimmten Liganden (Bindungspartner) zu Nutze. Benutzt man letztere Eigenschaft zur Reinigung eines Proteins, spricht man von Affinitätsreinigung oder Affinitätschromatographie. Im Falle des Enzyms GST benutzt man dessen Affinität zu dem Tripeptid N-Glu-Cys-Gly-C (kurz GSH), um es aus einem Proteinextrakt von E. coli, der ca. 1000 unterschiedliche Proteine enthält, zu reinigen. Der Ligand GSH wird zur Fixierung kovalent an eine Trägermatrix, z. B. Agarose, gebunden. Auf diese Matrix wiederum wird der Proteinextrakt aus E. coli gegeben, der GST enthält. Wie bereits erwähnt kann nur dieses an die Matrix binden, während die restlichen E. coli Proteine durch die Matrix laufen. GST kann wieder von der Matrix durch einen Überschuss an GSH ausgewaschen werden, freies GSH verdrängt also das Matrix gebundene GSH von der Glutathion-S-Transferase (Abb.2).
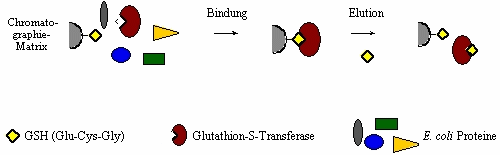
Abb.3 Reinigung der Glutathion-S-Transferase in schematischer Darstellung
Die Einzelschritte der Reinigung eines Proteins werden routinemäßig
durch eine analytische Diskontinuierliche Polyacrylamid Gelelektrophorese (kurz DiskPAGE) überprüft.
Die Ausbeute an gereinigtem GST Protein wird anschließend in einem
kolorimetrischen Test nach Bradford bestimmt. Um zu überprüfen, ob die
gereinigte Glutathion-S-Transferase aktiv ist, also in ihrer korrekten Tertiär-
bzw. Quartärstruktur vorliegt, wird ein enzymatischer Test durchgeführt.


