Lernzirkel: Carbonsäuren und Carbonsäure-Ester
Download Lernzirkel Tischvorlagen (PDF, 59 KB)
Download Lernzirkel Tischvorlagen (DOC, 112 KB)
Download Lernzirkel Tischvorlagen (ODT, 66 KB)
Download Lernzirkel Arbeitsblätter (PDF, 61 KB)
Download Lernzirkel Arbeitsblätter (DOC, 122 KB)
Download Lernzirkel Arbeitsblätter (ODT, 77 KB)
Download Lernzirkel Arbeitsblätter Lösung (PDF, 156 KB)
Download Lernzirkel Arbeitsblätter Lösung (DOC, 216 KB)
Download Lernzirkel Arbeitsblätter Lösung (ODT, 121 KB)
Laufzettel
Das Thema Carbonsäuren und Carbonsäure-Ester soll von Ihnen selbstständig erarbeitet werden mit Hilfe des Lernzirkels, der 11 Stationen umfasst.
Sie bearbeiten in Dreiergruppen (Zeitwart, Ordner, Sprecher) die Aufgaben der einzelnen Stationen.
- Es müssen alle Pflichtstationen (P) bearbeitet werden.
- Jede Station muss so verlassen werden wie sie vorgefunden wird: sauber, trocken...
- Tragen Sie die Lösungen sorgfältig in die entsprechenden Arbeitsblätter ein.
- Station 4 ist vor Station 5 zu bearbeiten!
- Die Wahlstationen (W) sind als sogenannte „Pausenstationen“ eingerichtet.
- Zeitvorgabe 170 Minuten (2 Doppel-Stunden)
Richtwerte für die einzelnen Stationen entnehmen Sie bitte unten stehender Tabelle (Zeitwart!) - Tragen Sie die bearbeiteten Stationen in diesen Laufzettel ein!
- Eine Musterlösung liegt für alle Gruppensprecher aus!
- Nicht bearbeitete Wahlstationen sind Hausaufgabe!
| Station | Thema | Methode | Zeit | bearbeitet |
|---|---|---|---|---|
| P Station 1 | Darstellung von Carbonsäuren | Versuch | 20 | |
| P Station 2 | Verhalten von Essigsäure in Wasser | Textanalyse/Versuch | 20 | |
| P Station 3 | Löslichkeit verschiedener Säuren | Versuch | 15 | |
| P Station 4 | Warum sind Carbonsäuren sauer? | Textanalyse | 15 | |
| P Station 5 | Stärke verschiedener Säuren | Versuch | 30 | |
| P Station 6 | Siedepunkte der Carbonsäuren im Vergleich | Tabellenauswertung | 15 | |
| P Station 7 | Nomenklatur wichtiger Carbonsäuren | Tabellenauswertung | 15 | |
| P Station 8 | Die Reaktion der Carbonsäure mit Alkoholen | Versuch | 15 | |
| W Station 9 | Triangolon | Puzzle | 10 |
P Station 1: Darstellung der Carbonsäuren
Vorzubereiten:
| Geräte | Chemikalien/Lösungen |
|---|---|
| Abzug!! | Acetaldehyd |
| 50 ml Becherglas | Indikatorpapier ?? (funktioniert nur in wässriger Lösung) |
| Bunsenbrenner | Kupferblech |
| Schmirgelpapier | |
| Papiertücher |
Tischvorlage
Carbonsäuren lassen sich durch Oxidation der entsprechenden Aldehyde darstellen.
Die Oxidation der Aldehyde kann in einem Versuch mit heißem Kupferoxid im Abzug durchgeführt werden.
Versuch:
- Geben Sie in ein kleines Becherglas soviel Aldehyd, dass der Boden des Glases gut bedeckt ist (ca. 5 ml).
- Erhitzen Sie nun in der Bunsenbrennerflamme ein blankes Kupferblech, bis es sich schwarz verfärbt, d. h. bis Kupferoxid entsteht.
- Dieses noch heiße Kupferblech tauchen Sie in das bereitgestellte Becherglas mit Acetaldehyd.
- Das benutze Kupferblech mit Papier abwischen und anschließend mit Schmirgelpapier blank putzen!
Arbeitsblatt
Ergebnis:
Das schwarze Kupferblech wird nach dem Eintauchen wieder blank.
Kupferoxid wurde zu metallischem Kupfer reduziert.
Ergänzen Sie in folgender Tabelle die Lücken in der homologen Reihe der Carbonsäuren (= Alkansäuren) und geben Sie die allgemeine Summenformel in folgender Form an: CxHyCOOH
| Anzahl der C-Atome | IUPAC-Name | Trivialname | Name der Salze | |
|---|---|---|---|---|
| 1 | Methansäure | Ameisensäure | Formiat | Methanoat |
| 2 | Ethansäure | Essigsäure | Acetat | Ethanoat |
| 3 | Propansäure | Propionsäure | Propionat | Propanoat |
| 4 | Butansäure | Buttersäure | Butyrat | Butanoat |
| 5 | Pentansäure | Valeriansäure | Valerat | Pentanoat |
| 6 | Hexansäure | Capronsäure | Capronat | Hexanoat |
| 10 | Decansäure | --- | --- | Decansäure |
| 16 | Hexadecansäure | Palmitinsäure | Palmitat | Hexadecanoat |
| 18 | Octadecansäure | Stearinsäure | Stearat | Octadecanoat |
Hausaufgabe:
- Erstellen Sie für die durchgeführte Reaktion die passende Reaktionsgleichung.
- Geben Sie zusätzlich für alle C-Atome die zugehörigen Oxidationszahlen (OZ) an.
- Zeigen Sie mit Hilfe der OZ, dass am ursprünglichen Carbonyl-C-Atom eine Oxidation stattgefunden hat.
- Kennzeichnen Sie die neu entstandene Carboxylgruppe.
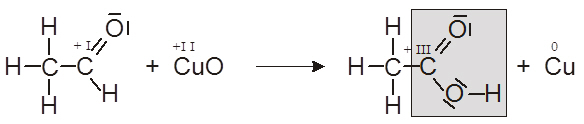
Oxidation: Oxidationszahl hat sich von + I auf + III erhöht!!
P Station 2: Das Verhalten von Essigsäure in Wasser
Vorzubereiten:
| Geräte | Chemikalien/Lösungen |
|---|---|
| Leitfähigkeitsmessgerät | Essigsäure |
| 6 große Reagenzgläser + Gestell | destilliertes Wasser |
| Messzylinder 25 ml | |
| 2 ml Pipette | |
| Glasstab groß |
Tischvorlage
Die Leitfähigkeit der Essigsäure in verschiedenen Verdünnungen kann durch ein spezielles Leitfähigkeitsmessgerät ermittelt werden.
Um aussagekräftige Ergebnisse zu erhalten, müssen Abstand und Eintauchtiefe der Elektroden sowie die Temperatur bei den einzelnen Messungen gleich sein.
Die beiden ersten Bedingungen werden dadurch eingehalten, dass im Messstab des Leitfähigkeitsmessgeräts beide Elektroden fixiert sind.
Essigsäure und destilliertes Wasser weisen Zimmertemperatur auf.
Die Messung erfolgt in Siemens [S].
Hinweis:
- Die Leitfähigkeit ist umso größer, je höher die Konzentration der Ionen der Lösung ist.
Wichtig:
Bei jeder Messung ~ 1 Minute warten, bis sich das Protolyse-Gleichgewicht eingestellt hat.
Durchführung:
- Geben Sie 15 ml reine Essigsäure (Eisessig) in ein trockenes, großes Reagenzglas und messen Sie die Leitfähigkeit.
- Entnehmen Sie die Elektrode.
- Pipettieren Sie zu den 15 ml Essigsäure 1,5 ml destilliertes Wasser, schütteln Sie und messen Sie die Leitfähigkeit.
- Entnehmen Sie die Elektrode.
- Geben Sie wieder 1,5 ml destilliertes Wasser zu, schütteln und messen erneut!
- Wiederholen Sie diesen Vorgang insgesamt fünfmal.
Der Protolysegrad α:
- Wird von einer schwachen Säure HA eine wässrige Lösung der Ausgangskonzentration c0 (HA) hergestellt, und haben sich nach der Einstellung des Gleichgewichts
HA + H2O ⇆ A- + H3O+
A--Teilchen der Konzentration c (A-) gebildet, so nennt man den Quotienten c(A-)/ cO(HA) den Protolysegrad α der Säure HA. -
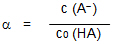
Ostwald-Verdünnungsgesetz:
- Der Protolysegrad α kann nur Werte zwischen 0 und 1 annehmen.
Mit zunehmender Verdünnung, d. h. mit abnehmender Ausgangskonzentration c0 nimmt α zu und strebt gegen 1. - α = 1 bedeutet vollständige Protolyse (Säure-Base-Reaktion) der Säure und ist bei allen sehr starken Säuren gegeben.
| Messung Nr. | Lösung | Leitfähigkeit |
|---|---|---|
| 1 | 15 ml Essigsäure (Eisessig) | 0 μS |
| 2 | 15 ml Essigsäure + 1,5 ml H2O dest. | 15 μS |
| 3 | 15 ml Essigsäure + 3,0 ml H2O dest. | 74 μS |
| 4 | 15 ml Essigsäure + 4,5 ml H2O dest. | 171 μS |
| 5 | 15 ml Essigsäure + 6,0 ml H2O dest. | 265 μS |
| 6 | 15 ml Essigsäure + 7,5 ml H2O dest. | 381 μS |
Protolysegleichung:
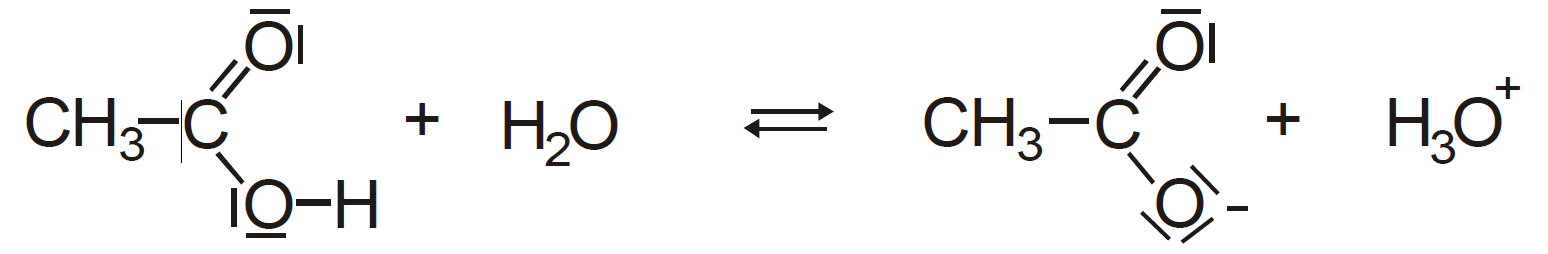
Beobachtung:
Mit zunehmender Verdünnung der Essigsäure nimmt die Leitfähigkeit zu.
Erklärung:
Da nach dem Ostwaldschen Verdünnungsgesetz der Protolysegrad α mit zunehmender Verdünnung zunimmt, steigt die Konzentration der Ionen und damit auch die Leitfähigkeit.
P Station 3: Die Löslichkeit verschiedener Carbonsäuren
Vorzubereiten:
| Geräte | Chemikalien/Lösungen |
|---|---|
| 8 Reagenzgläser | destilliertes Wasser |
| zwei 2-ml-Pipetten | Benzin |
| Stopfen für Reagenzgläser | Essigsäure |
| Spatel | Propansäure |
| 3 Tropfpipetten | Capronsäure (C6) |
| Stearinsäure |
Tischvorlage
Sie sollen in dieser Versuchsreihe die Löslichkeit verschiedener Carbonsäuren in zwei verschiedenen Lösungsmitteln untersuchen:
- in Wasser und
- in Benzin (gesundheitsschädlich, Xn, leichtentzündlich, F)
Durchführung:
- Geben Sie in je ein Reagenzglas 1 ml Wasser bzw. 1 ml Benzin.
- Fügen Sie jeweils etwas Carbonsäure (einige Tropfen bzw. eine kleine Spatelspitze) hinzu.
- Verschließen Sie das Reagenzglas mit einem Stopfen (nur bei Stearinsäure), schütteln Sie und bestimmen Sie die Löslichkeit.
- Der Versuch wird mit folgenden Carbonsäuren durchgeführt:
Essigsäure (ätzend, C) Siedetemperatur 118 °C Propansäure (ätzend, C) Siedetemperatur 141 °C Hexansäure (C 6) (ätzend, C) Siedetemperatur 205 °C Stearinsäure (C18) (reizend, Xi) Siedetemperatur 376 °C
Information:
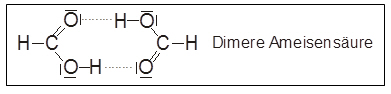
- Bemerkenswert ist, dass Carbonsäuren im festen und flüssigen Zustand sowie in unpolaren Lösungsmitteln als dimere Moleküle vorliegen.
Bildung von Doppelmolekülen, dergestalt, dass zwei Carbonsäuremoleküle zwei stabile Wasserstoffbrücken miteinander bilden.
| Säure | Löslichkeit in Wasser | Löslichkeit in Benzin |
|---|---|---|
| Essigsäure | gut löslich | gut löslich |
| Propansäure | löslich | gut löslich |
| Hexansäure (C 6) | sehr wenig löslich | löst sich vollständig |
| Stearinsäure (C18) | unlöslich | löst sich vollständig |
Erklärung:
- in Wasser:
Kurzkettige Carbonsäuren (bis 4 C-Atome) gut löslich, da Einfluss der polaren Carboxylgruppe überwiegt (Ausbildung von H-Brücken!!); Einfluss des unpolaren Restes bleibt noch klein, da kurz! - in Benzin:
Alle Carbonsäuren löslich, da:
lange Carbonsäuren mit ihrem langen, unpolaren Rest über Van-der Waals-Kräfte mit den unpolaren Benzinmolekülen in Wechselwirkung treten können; polare Carboxylgruppe im Verhältnis unbedeutend.
kurze Carbonsäuren sog. Dimere bilden, die nach außen unpolar sind.
P Station 4: Warum sind Carbonsäuren sauer?
Tischvorlage
- Carbonsäuren sind Säuren.
- Sie sind in der Lage in wässriger Lösung H3O+-Ionen zu bilden.
- Hierbei geben die Carbonsäuren das Proton in der Carboxylgruppe ab.
- Dieses lässt sich relativ leicht abspalten, während aus der OH-Gruppe der Alkohole eine solche Abspaltung kaum möglich ist.
- Die leichte Abspaltbarkeit des Protons muss daher mit der Nachbarschaft des Sauerstoffs der Carbonylgruppe zusammenhängen.
Induktiver Effekt:
- Besonders von G. N. Lewis und Sir C. Ingold erarbeitetes Konzept, das die Einflüsse zu erfassen sucht, die elektropositive oder -negative Substituenten in organischen Molekülen auf die Reaktivität ausüben.
- Ersetzt man in einer C–H-Bindung den Wasserstoff durch ein Atom oder eine Atomgruppe, so wird die Elektronendichte am Kohlenstoffatom in Abhängigkeit von der Elektronegativität des Substituenten verändert. Dies bezeichnet man als induktiven Effekt. Elektronegative Substituenten wirken elektronenziehend und erniedrigen dadurch die Elektronendichte, d. h. sie haben einen – I-Effekt. Alkylgruppen und Metallatome wirken elektronenschiebend, erhöhen also die Elektronendichte, d. h. besitzen einen + I-Effekt.
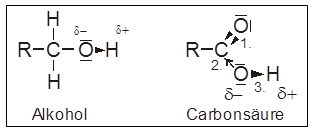
- Der Sauerstoff der Carbonylgruppe in der Carboxylgruppe ist stark elektronegativ und zieht die beiden Bindungselektronenpaare auf seine Seite (1. in Abb. unten)
Dieser Elektronenzug wirkt sich auch auf benachbarte Bindungen aus (2. und 3.)
– I-Effekt der Carbonylgruppe
Durch diesen wird die Polarität der O–H-Bindung verstärkt, so dass sie leichter heterolytisch gespalten werden kann, wobei ein Proton an den Reaktionspartner abgegeben wird.
- CH3COOH + H2O ⇆ CH3COO- + H3O+
Essigsäure + Wasser ⇆ Acetat + Hydroniumion - der – I-Effekt der Carbonylgruppe:
- I-Effekt = induktiver Effekt = Elektronenzug; d. h. Atome eines Moleküls bewirken aufgrund ihrer Elektronegativität einen Elektronenzug zu sich hin.
Der induktive Effekt der Carbonylgruppe der Essigsäure bewirkt, dass die Bindungselektronen zwischen Sauerstoff und Wasserstoff in der OH-Gruppe der Säure verstärkt zum Sauerstoff hin verschoben werden.
Hierdurch wird die Polarisierung stärker und der Wasserstoff lässt sich als Proton (H+) leichter abspalten. Dieser induktive Effekt fehlt bei Ethanol, also lässt sich das Proton an der OH-Gruppe nicht so leicht abspalten und d. h. Ethanol ist eine derart schwache Säure, dass es gegenüber Wasser sein H+ nicht abgibt!
P Station 5: Die Stärke verschiedener Säuren
Vorzubereiten:
| Geräte | Chemikalien/Lösungen |
|---|---|
| pH-Meter | Die Lösungen in Reagenzgläsern bereitstellen: |
| destilliertes Wasser zum Reinigen | 0,1 M Ameisensäure (0,38 ml Ameisensäure/100 ml Lösung) (ätzend, C) |
| Becherglas zum Abspülen | 0,1 M Essigsäure (0,57 ml Essigsäure/100 ml Lösung) (ätzend, C) |
| Papiertücher | 0,1 M Propansäure (0,75 ml Propansäure/100 ml Lösung)(ätzend, C) |
| 0,1 M Chlorethansäure (0,94 g Chlorethansäure/100 ml Lösung) (giftig, T, umweltgefährlich, N) |
Tischvorlage
Diese Station soll deutlich machen, durch welche Faktoren die Stärke einer Carbonsäure beeinflusst wird.
Es stehen folgende 0,1 molare Säurelösungen zur Verfügung:
| Ameisensäure | (ätzend, C) |
| Essigsäure | (ätzend, C) |
| Propansäure | (ätzend, C) |
| Chlorethansäure | (giftig, T, umweltgefährlich, N) |
- Bestimmen Sie die pH-Werte dieser Lösungen mit Hilfe eines pH-Meters.
Erläutern Sie die Ergebnisse.
Wichtig: Die Einstabmesskette nach jeder Messung mit destilliertem Wasser abspülen und trocknen! - Bearbeiten Sie als „Hausaufgabe“ die Tabelle des Arbeitsblattes zu dieser Station.
Hinweis:
Um die Ergebnisse deuten zu können, benötigen Sie folgende Information:
| + I-Effekt | - I-Effekt |
|---|---|
| Alkylgruppen z. B. Methyl-, Ethylgruppe etc. |
Halogene |
| Hydroxylgruppe | |
| bereits vorhandenes Carboxylation | Carbonylgruppe |
| Carboxylgruppe | |
| Doppelbindung |
- Ein zusätzlicher - I-Effekt führt zu einer Erhöhung der Säurestärke!
- Ein + I-Effekt führt zu einer Verminderung der Säurestärke!
Versuchsergebnisse:
| Säure | Strukturformel | pH-Wert |
|---|---|---|
| Ameisensäure | HCOOH | 1,9 |
| Essigsäure | CH3COOH | 2,3 |
| Propansäure | CH3-CH2-COOH | 2,5 |
| Chlorethansäure | 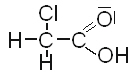 |
1,5 |
<b<Schlussfolgerung:
Chlorethansäure ist die stärkste Säure im Vergleich zu den anderen drei.
Sie ist stärker als Ethansäure, weil Chlor einen - I-Effekt ausübt, der zu einer noch stärkeren Polarisierung der OH-Gruppe führt, so dass noch leichter ein Proton abgespalten wird.
Die Säurestärke nimmt von Ameisensäure zu Propansäure ab.
Verantwortlich hierfür ist der + I-Effekt der Alkylgruppe. Je länger die Alkylgruppe, desto stärker der Elektronenschub. Dadurch wird dann die Polarisierung der OH-Gruppe schwächer, sodass das Proton weniger leicht abgespalten wird.
| Säureart | stärkste Säure davon | Grund | Beispiel mit pKS-Werten | ||
|---|---|---|---|---|---|
| Monoalkansäuren | je kürzer der Alkylrest, desto stärker die Säure | + I-Effekt der Alkylreste | Methansäure | 3,77 | |
| Ethansäure | 4,76 | ||||
| Propansäure | 4,88 | ||||
| 2,2 Dimethylpropansäure | 5,05 | ||||
| Halogenalkansäuren | je mehr Halogensubstituenten desto stärker die Säure | - I-Effekt der Halogene | Monojodethansäure | 3,13 | |
| Monochlorethansäure | 2,81 | ||||
| Monofluorethansäurec | 2,81 | ||||
| je höher die EN der Substituenten, desto stärker die Säure | Monobromethansäure | 2,87 | |||
| Dichlorethansäure | 1,29 | ||||
| Trichlorethansäure | 0,08 | ||||
| je näher die Substituenten an der Säuregruppe, desto stärker die Säure | 3 – Chlorbutansäure | 4,06 | |||
| 4 – Chlorbutansäure | 4,52 | ||||
| 2 – Chlorbutansäure | 2,84 | ||||
| Ketoalkansäuren | je näher die Ketogruppe an der Säuregruppe, ... | DB leicht polarisierbar - I-Effekt | 2 – Ketopropansäure (= Brenztraubensäure) |
2,50 | |
| Hydroxyalkansäuren | je näher die Hydroxygruppe an der Säuregruppe, ... | - I-Effekt | 2-Hydroxypropansäure (= Milchsäure) |
3,90 | |
| Dialkansäuren | je näher beide Säuregruppen zueinander stehen, ... | + I-Effekt der Alkylgruppe und Carboxylatgruppe | Ethandisäure | 1,46 | 4,40 |
| Propandisäuren | 2,83 | 5,85 | |||
| Butandisäure | 4,17 | 5,64 | |||
| Hexandisäure | 4,42 | 5,41 | |||
P Station 6: Siedepunkte der Carbonsäuren im Vergleich
Tischvorlage
Tabelle 1
| Substanz | Molekülmasse | Siedetemperatur [°C] |
|---|---|---|
| Ethansäure | 60 | 118 |
| Propansäure | 74 | 141 |
| Butansäure | 88 | 162,5 |
| Pentansäure | 12 | 187 |
Begründen Sie die unterschiedlichen Siedepunkte. Die Länge der Kohlenstoffkette nimmt von Ethansäure zu Pentansäure zu, damit nimmt auch die Elektronenzahl zu. Hierdurch werden die vdW-Kräfte im hydrophoben Teil der Kette größer und damit steigt die Siedetemperatur. Die Steilheit des Anstieges nimmt ab, da der Einfluss der polaren Carboxylgruppe mit der Kettenlänge abnimmt.
Tabelle 2
| Substanz | Molekülmasse | Siedetemperatur [°C] |
|---|---|---|
| Propanal | 58 | 49 |
| 1-Propanol | 60 | 97 |
| Essigsäure | 60 | 118 |
| Butan | 58 | -0,5 |
Trotz ähnlicher Molekülmassen sind hier große Unterschiede.
Begründen Sie die unterschiedlichen Siedepunkte.
Butan besitzt den niedrigsten Siedepunkt:
- ist ein vollkommen unpolares Molekül
Zwischen den Butanmolekülen wirken ausschließlich die relativ schwachen Van-der-Waals-Kräfte.
Propanal siedet höher als Butan:
- Die Carbonylgruppe ist polarisiert; der Sauerstoff trägt eine negative Teilladung, der Kohlenstoff eine positive.
Die Ausbildung von Dipol-Dipol-Kräften ist möglich, sind stärker als die Van-der-Waals-Kräfte
Die Moleküle werden stärker zusammengehalten ➔ höhere Siedetemperatur
1-Propanol siedet höher als Propanal:
- Auch bei Propanol liegt eine Polarisierung vor; wieder ist der Sauerstoff negativ polarisiert; positiv ist hier aber der Wasserstoff polarisiert.
Die Polarisierung zwischen O und H ist stärker als zwischen O und C.
Zwischen Propanol-Molekülen können die starken H-Brücken ausgebildet werden.
Alkohole sieden höher als Alkanale vergleichbarer Molekülmasse.
Essigsäure siedet höher als 1-Propanol:
- Sowohl die C=O-Gruppe als auch die OH-Gruppe ist polarisiert.
Jedes Säuremolekül kann zwei H-Brücken ausbilden, Alkoholmoleküle aber nur jeweils eine.
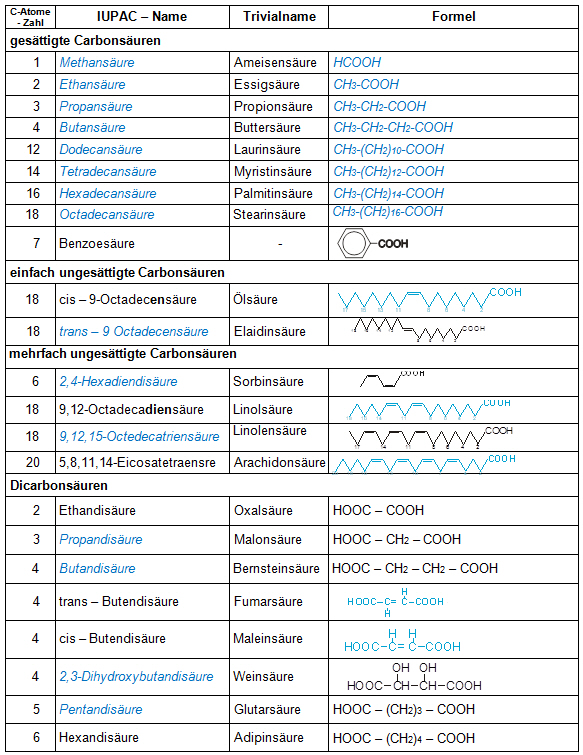
P Station 7: Nomenklatur wichtiger Carbonsäuren
Tischvorlage
Ergänzen Sie die Lücken auf Ihrem Arbeitsblatt!
P Station 8: Reaktionen der Carbonsäuren mit Alkoholen
Vorzubereiten:
| Geräte | Chemikalien/Lösungen | |
|---|---|---|
| 6 Reagenzgläser | Ethansäure | Methanol |
| Tropfpipette | Propansäure | Ethanol |
| zwölf 2-ml-Pipetten für Alkohole und Säuren | 2-Methylbuttersäure | |
| 0,1 M Propansäure (0,75 ml Propansäure/100 ml Lösung)(ätzend, C) |
Butan-1-ol | |
| Zimtsäure | 3-Methyl-1-butanol | |
| Benzoesäure | Pentan-1-ol | |
| Salicylsäure | Hexan-1-ol | |
| konz. Schwefelsäure | Octan-1-ol | |
Tischvorlage
Carbonsäureester
Die Bildung der Carbonsäureester verläuft vereinfacht nach folgendem Schema:
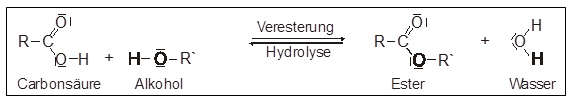
Benennung eines Esters:
Name der Carbonsäure + Restname des Alkohols + Endung –ester
Beispiel:
- Säure: Essigsäure, Alkohol: Methanol
- Ester: Essigsäure-methyl-ester
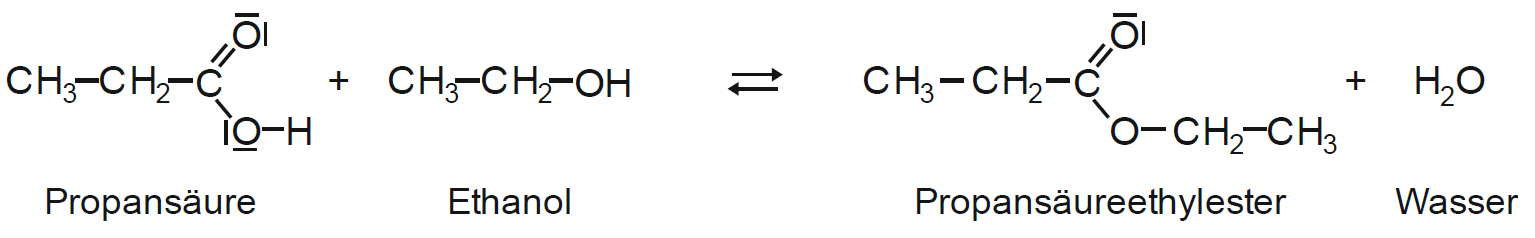
Versuch:
In einem Reagenzglas werden eine Carbonsäure und ein Alkohol in den in der Tabelle angegebenen Mengen gemischt. Dann pipettiert man 1 ml konzentrierte Schwefelsäure (V O R S I C H T !!) hinzu.
Nun wird gut gemischt und anschließend prüft man den Geruch!
Stellen Sie maximal zwei Ester her!
| Säure | Alkohol | H2SO4konz. | ||
|---|---|---|---|---|
| Essigsäure | 2 ml | Octan-1-ol | 2 ml | 1 ml |
| Essigsäure | 2 ml | Butan-1-ol | 2 ml | 1 ml |
| Essigsäure | 2 ml | Pentan-1-ol | 2 ml | 1 ml |
| Propansäure | 2 ml | Ethanol | 2 ml | 1 ml |
| Benzoesäure | 1 Spatelspitze | Ethanol | 3 ml | 1 ml |
| Salicylsäure | 1 Spatelspitze | Methanol | 1 ml | 1 ml |
| Propansäure | 2 ml | Butan-1-ol | 2 ml | 1 ml |
| Ethansäure | 2 ml | 3-Methyl-1-butanol | 2 ml | 1 ml |
| Ethansäure | 2 ml | 1-Pentanol | 2 ml | 1 ml |
| 2-Methylbuttersäure | 2 ml | Hexanol | 2 ml | 1 ml |
| Zimtsäure | 1 Spatelspitze | Ethanol | 2 ml | 1 ml |
| Säure | Alkohol | Ester | Geruch |
|---|---|---|---|
| Essigsäure | Octan-1-ol | Essigsäureoctylester | Spülmittel |
| Essigsäure | Butan-1-ol | Essigsäurebutylester | Apfel |
| Essigsäure | Pentan-1-ol | Essigsäurepentylester | Birne |
| Propansäure | Ethanol | Propansäureethylester | Gletscher-Eis-Bonbon |
| Benzoesäure | Ethanol | Benzoesäureethylester | künstlich, fruchtig |
| Salicylsäure | Methanol | Salicylsäuremethylester | Pfefferminz,muffig |
| Propansäure | Butan-1-ol | Propansäurebutylester | Rum |
| Ethansäure | 3-Methyl-1-butanol | Ethansäure-(3-Methyl-1-butyl)-ester | Birne |
| Ethansäure | 1-Pentanol | Etansäure-1-pentylester | Etansäure-1-pentylester |
| 2-Methylbuttersäure | Hexan-1-ol | 2-Methyl-buttersäurehexylester | Apfel/Birne |
| Zimtsäure | Ethanol | Zimtsäureethylester | Pfirsich |
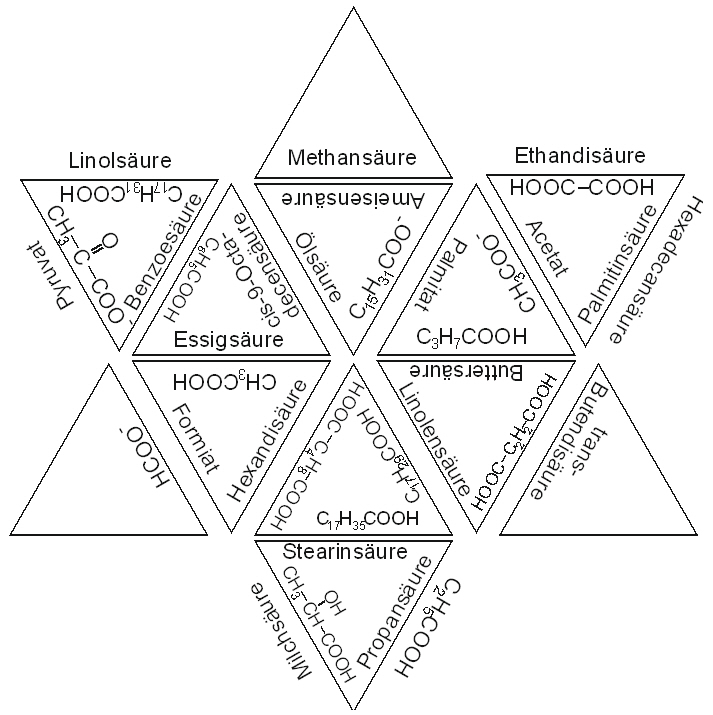
W Station 9: Triangolon
Tischvorlage
Arbeitsauftrag:
Schneiden Sie zunächst die Dreiecke auseinander.
Legen Sie die passenden Seiten der Dreiecke aneinander. Welche Form ergibt sich dabei?
Ergänzen Sie nun selbst an den Außenseiten die fehlenden Formeln und Namen.