Titration von Aminosäuren
Download Titrationskurve (PDF, 145 KB)
Download Titrationskurve (DOC, 195 KB)
Download Titrationskurve (ODT, 95 KB)
Download Titrationskurve Lösung (PDF, 1214 KB)
Download Titrationskurve Lösung (DOC, 190 KB)
Download Titrationskurve Lösung (ODT, 77 KB)
- Aufnahme der Titrationskurve
Analytisches Verfahren, bei dem Maßlösung (hier: Natronlauge) tropfenweise einer Probelösung (hier: saure Glycinlösung) zugesetzt wird. Dabei wird kontinuierlich der pH-Wert gemessen.
Bauen Sie die Apparatur nach folgender Skizze auf:
Beschriften Sie die Skizze.
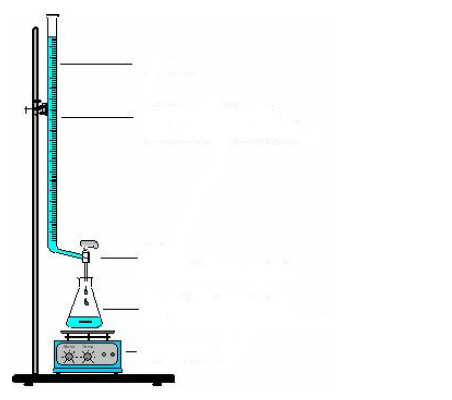
Durchführung:
- 50 ml einer Glycin-Lösung mit c = 0,1 mol/l in Salzsäure c(H3O+) = 0,1 mol/l wird in dem Erlenmeyerkolben vorgelegt.
- Mit Hilfe eines pH-Messgeräts wird der pH-Wert der Glycin-Lösung bestimmt.
- In Schritten von 1 ml wird Natronlauge mit c = 0,5 mol/l unter Rühren zugegeben; der pH-Wert wird nach jeder Zugabe notiert.
- Es wird bis zu einem Verbrauch von 25 ml Natronlauge titriert.
- Die gemessenen pH-Werte werden in Abhängigkeit vom Volumen der zugegebenen Natronlauge zunächst in eine Wertetabelle und anschließend in ein Diagramm eingezeichnet.
Zu Beginn hat die Lösung einen pH-Wert von etwa 2.
Der pH-Wert steigt nur langsam. Nach Zugabe von etwa 9 ml Natronlauge steigt der pH-Wert sprunghaft an. Anschießend steigt der pH-Wert wiederum nur langsam an. Nach Zugabe von 25 ml NaOH hat die Lösung einen pH-Wert zwischen 12 und 13.
Ergebnis:
Wertetabelle
V(NaOH)
in ml
0
1
2
3
4
5
6
7
8
9
10
11
12
pH-Wert
2,2
2,29
2,41
2,55
2,71
2,89
3,11
3,46
5,67
8,67
9,2
9,41
9,59
V(NaOH)
in ml
13
14
15
16
17
18
19
20
21
22
23
24
pH-Wert
9,77
9,97
10,17
10,43
10,88
11,42
11,74
11,9
12,01
12,09
12,16
12,21
Erstellung des Volumen-pH-Diagramms - Interpretation der Titrationskurve
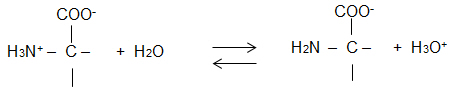
2.1 Geben Sie die Strukturformeln von Glycin bei pH = 1, pH = 6, pH = 13 an.
pH 1: Kation, pH 6: Zwitterion, pH 13: Anion
evtl. zu der gezeichneten Kurve eintragen
2.2 Formulieren Sie das Protolyse-Gleichgewicht zu Beginn der Titration, d. h. V(NaOH) = 0 ml.
GG liegt auf der linken Seite, es liegen hauptsächlich Kationen vor.
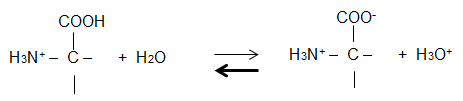
2.3 Erläutern Sie die Wirkung zugegebener OH- -Ionen auf das bestehende Protolyse-Gleichgewicht anhand einer
Reaktionsgleichung.
Geben Sie die Strukturformeln von Glycin am Halbäquivalenzpunkt (= pKs1) an.
pH-Wert steigt kaum an.
Störung des GG durch OH- -Ionen: H3O+ + OH- 2 H2O
H3O+ werden aus dem GG entfernt, GG-Verschiebung in Richtung Zwitterion.
Am Halbäquivalenzpunkt liegt das GG in der Mitte, also c(Kation) = c(Zwitter-ion) (eintragen in Kurve)2.4 Erläutern Sie die chemischen Vorgänge bei weiterer Zugabe von OH--Ionen.
Machen Sie eine Aussage über das Protolyse-Gleichgewicht am IEP.
Permanente Störung des GG durch Reaktion zugegebener OH--Ionen mit den H3O+-Ionen. GG-Verschiebung nach
rechts in Richtung Zwitterion. Am IEP ist das GG ganz nach rechts verschoben, es liegen nur noch Zwitterionen vor.2.5 Der IEP stellt den Äquivalenzpunkt oder den Wendepunkt der Titrationskurve dar. Am Äquivalenzpunkt gilt:
Die Stoffmenge an zugegebener Maßlösung entspricht exakt der Stoffmenge an vorgelegter Säure. Welche
Teilchen liegen nun in der Probe vor?
Zwitterionen und Wassermoleküle2.6 Machen Sie eine Aussage über die Wirkung weiter zugegebener OH--Ionen.
OH--Ionen erhöhen den pH-Wert, sie gehen keine Reaktion ein.
2.7 Formulieren Sie das Protolyse-Gleichgewicht bei pH ≈ 9.
Bei pH 9 verändern zugegebene OH--Ionen den pH-Wert kaum.
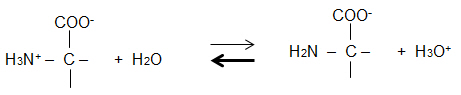
2.8 Erläutern Sie die Wirkung zugegebener OH--Ionen auf dieses Protolyse-Gleichgewicht anhand einer
Reaktionsgleichung.
Geben Sie die Strukturformeln von Glycin am Halbäquivalenzpunkt (=pKs2) an.pH-Wert steigt kaum an.
Störung des GG durch OH--Ionen: H3O+ + OH- 2 H2O
H3O+-Ionen werden aus dem GG entfernt, GG-Verschiebung in Richtung Anion.
Am Halbäquivalenzpunkt liegt das GG in der Mitte, also c(Zwitterion) = c(Anion), evtl. Eintrag in die Kurve2.9 Welche Teilchen liegen bei Zugabe von 25 ml NaOH vor?
Anionen, Wassermoleküle und OH--Ionen
2.10 Welchen pH- Wert hat die Probelösung zu diesem Zeitpunkt?
pH-Wert der verwendeten Natronlauge
- Bestimmung des pH-Bereichs in dem Glycin gute Puffereigenschaften hat.
3.1 Aminosäuren haben Puffereigenschaften.
Erläutern sie diese Eigenschaften in Worten. Definieren Sie, was man unter einer Pufferlösung versteht.Aminosäuren besitzen die Fähigkeit, den pH-Wert nahezu konstant zu halten, trotz Zugabe geringer Mengen
H3O+-Ionen bzw. OH--Ionen.3.2 Geben Sie die pH-Bereiche an, in denen Glycin gute Puffereigenschaften hat
Zeichnen Sie diesen Bereich in das Diagramm ein.
3.3 Wie liegt Glycin in diesen pH-Bereichen vor?
Optimal puffert Glycin in zwei pH-Bereichen:
1. wenn gilt: c(Kation) = c(Zwitterion)
2. wenn gilt: c(Zwitterion) = c(Anion)3.4 Aminosäuren puffern am besten bei ihren jeweiligen pKs-Werten.
- Formulieren Sie das Protolyse-Gleichgewicht von Glycin, das durch pKs1 gekennzeichnet ist.
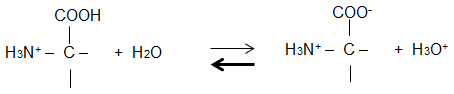
- Formulieren Sie das MWG für dieses Protolyse-Gleichgewicht.
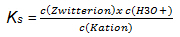
- Umformulierung des mathematischen Ausdrucks:
c(H3O*) soll als pH ausgedrückt werden.
Es gilt: pH= -lg c(H3O*)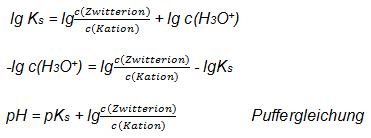
3.5 Zeigen Sie, dass gilt:
Glycin puffert am besten bei dem pH-Wert, der dem pKs1-Wert entspricht.
Wenn pH = pKs1, dann ist das Verhältnis c(Zwitterion) : c(Kation) = 1 : 1 = 1
dann gilt: lgc(Zwitterion)/c(Kation) = lg 1 = 0, also pH = pKs1
Glycin puffert gut in einem pH-Bereich der dem pKs-Wert ± 1 entspricht.
Es gilt: Verhältnis c(Zwitterion) : c(Kation) = 10 : 1 oder 1 : 10
Dann gilt: lgc(Zwitterion/c(Kation) = lg 10 = 1
bzw. lgc(Zwitterion)/c(Kation) = lg 0,1 = -13.6 Geben Sie mit Hilfe der Hilfsmitteltabelle den pH-Bereich an, in dem Glycin gut puffert.
pH-Bereich: 1,34 – 3,34
Formulieren Sie die Pufferwirkung in diesem pH-Bereich bei zugegebenen H3O+ - bzw. zugegebenen OH—Ionen.
Kation + OH- Zwitterion + H2O
Zwitterion + H3O+ Kation + H2O3.7 Leiten Sie mathematisch den zweiten Pufferbereich von Glycin her.
Siehe dann 3.4 – 3.6: statt Zwitterion Anion einsetzen und statt Kation Zwitterion verwenden.
- Formulieren Sie das Protolyse-Gleichgewicht von Glycin, das durch pKs1 gekennzeichnet ist.
- Aufgaben zum Thema Eigenschaften der AS und der Pufferwirkung
Gegeben ist der Dihydrogenphosphat/Hydrogenphosphat-Puffer.
H2PO4-/HPO42-
Säure/korrespondierende Base4.1 Zeigen Sie die Pufferwirkung dieses Puffers bei Zugabe geringer Mengen H3O+- bzw. OH- -Ionen
mit Hilfe von entsprechenden Reaktionsgleichungen.Zugabe von H3O+: HPO42- + H3O+ → H2PO4- + H2O
Zugabe von OH-: H2PO4- + OH- → HPO42- + H2O
4.2 Bestimmen Sie mathematisch den pH-Wert, an dem dieser Puffer puffert.
Dieser Puffer puffert optimal, wenn gilt: c(Base ) : c(Säure) = 1 : 1
Dieser Puffer puffert gut, wenn gilt c(Base) : c(Säure) = 10 : 1 oder 1 : 10
Eingesetzt in die Puffergleichung: pH = pKs + lg c(Base) : c(Säure)
pH = 7,2 + lg 101 bzw. pH = 7,2 + lg10-1
pH = 7,2 ± 1
4.4 Gegeben ist die Titrationskurve von Histidin.
Interpretieren Sie diese Titrationskurve.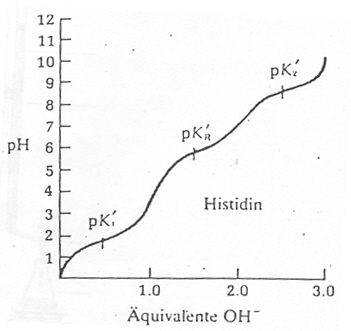
Histidin bei verschiedenen pH-Werten:
pH 1: hauptsächlich zweiwertiges Kation pH 1,8: c(zweiwertiges Kation) = c(einwertiges Kation) pH 4: hauptsächlich einwertiges Kation pH 6: c(einwertiges Kation) = c(Zwitterion) pH 7,6: hauptsächlich Zwitterion pH 9,2: c(Zwitterion) = c(Anion) pH 10: hauptsächlich Anion
4.5 Warum kann ein Gemisch aus starker Säure und ihrer korrespondierenden Base nicht puffern?
Starke Säure protolysiert fast vollständig. C(Base) ist sehr klein.
C(Base) : c(Säure) ist unendlich klein, also nicht 10 : 1 oder 1 : 10.4.6 Welche der folgenden Aussagen sind richtig, welche sind falsch?
Berichtigen Sie die falschen Aussagen.
- In einer wässrigen AS-Lösung liegen hauptsächlich Zwitterionen vor.
- Der pH-Wert einer wässrigen AS-Lösung entspricht dem IEP.
- Am IEP = pHI liegt die höchste Konzentration an Zwitterionen vor.
- Eine wässrige AS-Lösung hat am IEP die geringste Löslichkeit.
Alle Antworten richtig.


