Proteine – Denaturierung, Übungsaufgaben
Download Denaturierung, Übungsaufgaben (PDF, 81 KB)
Download Denaturierung, Übungsaufgaben (DOC, 145 KB)
Download Denaturierung, Übungsaufgaben (ODT, 131 KB)
Download Denaturierung, Übungsaufgaben Lösung (PDF, 25 KB)
Download Denaturierung, Übungsaufgaben Lösung (DOC, 29 KB)
Download Denaturierung, Übungsaufgaben Lösung (ODT, 11 KB)
- Ordnen Sie den unten abgebildeten Strukturen folgende Begriffe zu:
Tipp: Schneiden Sie die Strukturen aus und kleben Sie diese in einer sinnvollen Reihenfolge in Ihr Heft, beschriften Sie diese anschließend.
Primärstruktur (4), Sekundärstruktur (1 und 6), Tertiärstruktur (2 und 5), Quartärstruktur (3),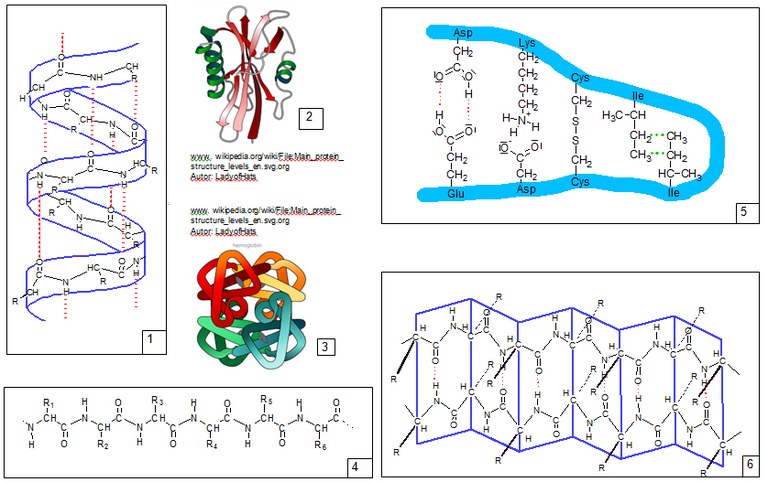
- Benennen Sie die Strukturen mit den Fachbegriffen und erläutern Sie die Kräfte, die die jeweilige Struktur stabilisieren. Verwenden Sie dabei folgende Begriffe:
α-Helix – Aminosäuresequenz – ß-Faltblatt – Disulfidbrücken – H-Brücken – Ionenbindung – Peptidbindungen – räumliche Anordnung – Aminosäurereste – Spirale – Van-der-Waals-Kräfte – Peptidgruppen – intramolekular – intermolekular – Wechselwirkungen/zwischenmolekulare Kräfte
Primärstruktur:
Sie beschreibt die Aminosäuresequenz innerhalb einer Peptidkette. Aminosäuren sind durch Peptidbindungen miteinander verknüpft.
Sekundärstruktur:
Sie beschreibt die räumliche Anordnung der Peptidketten z. B. als α-Helix (= Spirale) oder als ß-Faltblatt. Die Sekundärstruktur wird stabilisiert durch intramolekulare oder intermolekulare H-Brücken zwischen den Peptidgruppen.
Tertiärstruktur:
Sie beschreibt die räumliche Anordnung eines Proteinmoleküls. Die Tertiärstruktur wird stabilisiert durch Wechselwirkungen/zwischenmolekulare Kräfte der Aminosäurereste:
Ionenbindungen, Disulfidbrücken, H-Brücken, Van-der-Waals-Kräfte.Quartärstruktur:
Sie beschreibt die räumliche Anordnung mehrerer Polypeptidketten zueinander unter Ausbildung eines Gesamtkomplexes. Die Quartärstruktur wird stabilisiert durch Wechselwirkungen/zwischenmolekulare Kräfte der Aminosäurereste:
Ionenbindungen, Disulfidbrücken, H-Brücken, Van-der-Waals-Kräfte. - Zu allen im Folgenden beschriebenen Fällen gehört ein gemeinsamer Überbegriff.
Geben Sie diesen Begriff an. Denaturierung
Erklären Sie anschließend die chemischen Vorgänge dieser Beispiele ausführlich. Beziehen Sie sich dabei auf die Inhalte von Aufgabe 1 und 2.
a) Sie braten ein Spiegelei, das Eiweiß ändert die Farbe.
Durch Hitzeeinwirkung werden die Sekundär-, Tertiär- und Quartärstruktur der Proteine zerstört und sie verlieren ihre biologische Funktion. Dabei werden Wasserstoffbrücken aufgebrochen, kovalente Bindungen bleiben erhalten ➔ Primärstruktur bleibt erhalten.
b) Sie geben aus Versehen Zitronensaft und Milch in Ihren Tee.
Bei Zugabe von Säure zu Proteinlösungen lagern sich Protonen aus der Säure z. B. an Carboxylatgruppen der Aminosäurereste an ➔ Ionenbindungen werden aufgelöst, Proteine werden umgefaltet und Tertiär- und Quartärstruktur gehen verloren.
c) Zur Herstellung eines Biskuitkuchens schlagen Sie Eiklar zu Eischnee.
Durch mechanische Einwirkung werden H-Brücken zerstört ➔ Veränderungen in der Quartär-, Tertiär- und teilweise Sekundärstruktur der Eiproteine. Die Denaturierung ist reversibel. Nach einiger Zeit wird der Eischnee wieder flüssig.
d) In einem Praktikumsversuch geben Sie zu einer Proteinlösung Blei(II)-chlorid (PbCl2). Sie beobachten eine Ausfällung des Proteins.
Schwermetallionen (z. B. Blei-Ionen) gehen mit negativ geladenen Aminosäureresten (z. B. mit Carboxylatgruppen) Ionenbindungen ein und verändern so die Quartär- und Tertiärstruktur.


