Chromatografie
Download Chromatografie (PDF, 244 KB)
Download Chromatografie (DOC, 388 KB)
Download Chromatografie (ODT, 256 KB)
Einführung
Chromatografie ist eine Trenntechnik.
Ziel: Auftrennung der einzelnen Bestandteile eines Substanzgemisches
Prinzip: Unterschiedliche zeitliche Verzögerung (Retention) der einzelnen Analyten durch unterschiedlich starke Wechselwirkungen mit dem chromatografischen System, das aus einer stationären Phase und einer mobilen Phase besteht.
Aufgabe der stationären Phase:
Wechselwirkungen mit den Bestandteilen der Probe (Analyten)
Aufgabe der mobilen Phase:
Transport (in Gas- und Flüssigkeitschromatografie)
Beeinflussung der Wechselwirkungen der Analyten mit der stationären Phase (in der Flüssigkeitschromatografie).
Art der Wechselwirkungen mit der stationären Phase: Adsorption und/oder Verteilung
Adsorption: Anlagern von Teilchen an eine feste Oberfläche an der Phasengrenz-fläche zu einer gasförmigen oder einer flüssigen Phase. Der entgegengesetzte Vorgang ist die Desorption, d. h. das Freisetzen adsorbierter Teilchen in die andere Phase. Die Stärke der Adsorption ist u. a. abhängig von der Art der stationären Phase, der Art der Probenkomponenten und der Temperatur.
Verteilung: Aufenthalt von Teilchen in zwei benachbarten, nicht mischbaren Phasen bzw. Übergang einer Substanz zwischen den Phasen. Der Grad der Verteilung ist u. a. abhängig von der Art der Substanz, den beteiligten Phasen und der Temperatur.
Verschiedene Arten der Chromatografie:
Gaschromatografie
Flüssigkeitschromatografie
- Gaschromatografie (engl. Gas Chromatography, GC)
Voraussetzung: Die Analyten sind unzersetzt verdampfbar.
mobile Phase: gasförmig = Trägergas (Carrier)
- dient dem Transport der Analyten- typische Trägergase: Helium, Wasserstoff, Stickstoff
stationäre Phase: fest oder flüssig
- befindet sich in der sog. GC-Säule, bestimmt die Selektivität des Systemsflüssige stationäre Phase: Gas Liquid Chromatography, GLC
- am weitesten verbreitet
- hoch siedende Polymere: Polysiloxane oder Polyethylenglykole- gepackte Säule: Festes Trägermaterial (z. B. Chromosorb) wird mit der flüssigen
stationären Phase beschichtet.
- Kapillarsäule (WCOT-Säule, = engl. Wall Coated Open Tubular): Flüssigkeit wird
als dünner Film auf die Innenwand der Kapillare aufgebracht
Trennprinzip: Verteilung zwischen Flüssigkeit und Gasphase, Beschleunigung des Übergangs in die mobile Phase durch Temperaturerhöhung
Anwendungsbereich: unzersetzt verdampfbare Substanzen mit Siedepunkten bis ca. 350 °C (unter gewissen Voraussetzungen auch höher) -
Flüssigkeitschromatografie (engl. Liquid Chromatography, LC)
stationäre Phase: festmobile Phase (Laufmittel, Eluent): flüssig
Verschiedene Arten, z. B.
HPLC (Hochdruckflüssigkeitschromatografie, engl. High Pressure Liquid Chromatography bzw. Hochleistungsflüssigkeitschromatografie, engl. High Performance Liquid Chromatography),
DC (Dünnschichtchromatografie, engl. Thin Layer Chromatografy, TLC),
PC (Papierchromatografie)
Lesen Sie dazu auch in Ihrem Chemiebuch oder recherchieren Sie im Internet.
Grundbegriffe der Chromatografie in der Praxis
- Führen Sie eine einfache Papierchromatografie durch und erstellen Sie eine Versuchsskizze, in der alle folgenden Teile auftauchen:
mobile Phase, stationäre Phase, Trennkammer, Startlinie, Stoffprobe 1
- Ordnen Sie jedem Begriff in der Tabelle eine der folgenden Erklärungen zu!
- fester Stoff mit großer Oberfläche (z. B. Cellulose)
- Hier werden die zu untersuchenden Proben aufgetragen.
- Flüssigkeit oft aus mehreren Bestandteilen gemischt, führt die Stoffprobe(n) an der stationären Phase vorbei.
- Bis hier hin wandert die mobile Phase (= Laufmittel).
- Glasgefäß mit gut schließendem Deckel
- Folie, auf die eine dünne Schicht (= die stationäre Phase) aufgezogen ist.
Begriff
Erklärung
stationäre Phase
mobile Phase
Startlinie
Laufmittelfront
Trennkammer
DC-Folie
Arbeitsweise der Dünnschicht-Chromatografie (DC)
Material- und Geräteliste
- Dünnschichtfolie (= DC-Folie), weicher Bleistift, Lineal
- zu untersuchende Lösungen
- Glaskapillare
- Filterpapier
- Lösungsmittelgemisch
- Chromatografiekammer (= Trennkammer) mit Deckel
- Fön
Arbeitsabläufe bei der DC (vereinfacht)
|
ggf. Abbildung einfügen |
||
| 1. Auftragen der Proben | 2. Entwickeln des Chromatogramms | 3. Auswertung des Chromatogramms |
- Vorbereiten der DC-Platte und Auftragen der Probe(n)
- Vorsicht! Schicht nicht verletzen, sauber arbeiten!
- Startlinie markieren.
- Startpunkte einzeichnen (ausreichender Abstand).
- zu untersuchende Lösungen als möglichst kleinen Fleck in Punktform bzw. Bandenform auftragen, Spitze der Kapillare dabei vorsichtig auf die DC-Platte aufsetzen
- aufgetragenen Flecken nicht in das Lösungsmittelgemisch eintauchen
- Vor jeder neu zu untersuchenden Lösung Kapillare mehrmals spülen (Lösungsmittel aufziehen und auf Filterpapier entleeren).
- Entwickeln des Chromatogramms
- Wenn das Lösungsmittel ca. 1 cm vor dem oberen Ende der DC-Platte angekommen ist, wird die DC-Platte entnommen.
- Die Lösungsmittelfront wird mit Bleistift genau markiert, und die DC-Platte wird getrocknet (Abzug!).
- Vor Beginn des Entwickelns müssen die Flecken getrocknet sein.
- Auswertung des Chromatogramms
- Nach dem Trocknen werden alle sichtbaren (Farb-)Stoffe mit Bleistift vorsichtig umrandet.
- Wenn nur farbige Substanzen enthalten sind, werden alle Reinstoffe detektiert (festgestellt, aufgespürt).
- Beobachtungen und Ergebnisse werden notiert.
- Beobachtet werden kann u. a.:
Die Anzahl der Flecken, die über dem aufgetragenen Fleck sichtbar werden
(= Anzahl der Reinstoffe in der Probe). - Ergebnis ist z. B.:
Die aufgetragenen Lösungen sind Stoffgemische bzw. Reinstoffe. - Unsichtbare Substanzen müssen mit geeigneten Substanzen identifiziert werden.
Auswertung von Chromatogrammen
Die Auswertung von Chromatogrammen bietet verschiedene Möglichkeiten:
- Bestimmung der Anzahl der Komponenten eines Stoffes
Hier ist die Auswertung nur quantitativ. Über die einzelnen Stoffe lassen sich keine Aussagen machen. - Der Rf-Wert = Retentionsfaktor
Die qualitative Auswertung erfolgt durch Vergleichen der Rf -Werte der Proben mit dem der reinen Vergleichsubstanzen.
Berechnung des Rf –Wertes = Entfernung vom Fleckmittelpunkt zum Start = Entfernung der Laufmittelfront zum Start
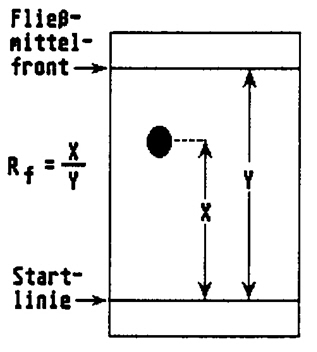
- Rf-Werte (Retentionsfaktor) sind immer kleiner als ___________ und werden auf zwei Dezimalen berechnet.
- Der Rf-Wert ist u. a. abhängig von:
-
-
- - Bedingt durch die Abhängigkeiten kann es schwer sein Rf-Werte eindeutig zu reproduzieren.
- Auftragen einer Vergleichssubstanz
Will man herausfinden, ob ein bestimmter Reinstoff in dem zu untersuchenden Stoff- gemisch enthalten ist, kann man das auf folgende Weise herausfinden:
Man trägt neben der Probe des Stoffgemisches eine Probe des Reinstoffes als Vergleich auf.
Übungen zur Auswertung mittels Rf-Wert
Aufgabe 1
- Ermitteln Sie die Rf-Werte für alle Reinstoffe in ihrem Chromatogramm aus dem Versuch „Trennung von Blattfarbstoffen“.
Vergleichen Sie Ihre Werte mit den ermittelten Werten in b) - Ermitteln Sie die Rf-Werte für 4 der insgesamt 6 Reinstoffe aus dem abgebildeten Chromatogramm

-
Gegeben ist folgendes Dünnschichtchromatogramm.
Werten Sie das Diagramm aus und ermitteln Sie alle Rf-Werte der Stoffprobe 2.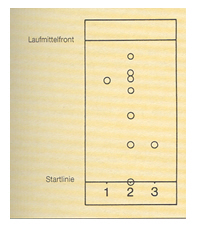
Aufgabe 2
- Identifizieren Sie in Abb. 1 und 2 Stoffe anhand der Vergleichsauftragung.
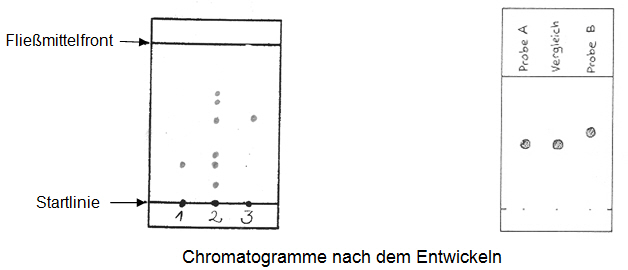
Abb.1. Die zu analysierende Probe ist ein Stoffgemisch.
(1) = Lichtblau/Vergleichssubstanz
(2) = Stoffgemisch
(3) = Chromgrau/Vergleichsubstanz
Abb. 2. Die zu analysierenden Proben sind Reinstoffe. -
Welche Reinstoffe lassen sich im Stoffgemisch nachweisen?
-
Welche Probe entspricht dem Vergleich?
Trennung von Blattfarbstoffen durch DC
Information
Bevor Pflanzenfarbstoffe durch Chromatografie analysiert werden können, muss man sie durch Extraktion aus Pflanzenteilen isolieren.
Aufgabe
a) Trennen Sie die Blattfarbstoffe von Spinat auf und verwenden Sie dazu zwei verschiedene DC-Folien (Kieselgel und Cellulose).
b) Erstellen Sie eine möglichst genaue Skizze des entwickelten Chromatogramms.
c) Vergleichen Sie die beiden Extrakte bezüglich ihrer Zusammensetzung.
stationäre Phase: Kieselgel/Cellulose
mobile Phase: Isopropanol/PE/Wasser (v/v/v 10:100:0,25)
zu trennende Probe: Blattextrakt
Versuchsdurchführung
- Herstellen der Blattextrakte:
Blätter werden zerkleinert.
Dann werden sie in der Reibschale mit Sand und ca. 5 ml Aceton zerrieben (im Abzug). Die Lösungen werden in Schnappdeckelgläser abdekantiert und die Gläser werden verschlossen.
- Durchführung der DC-Chromatografie entsprechend der Regeln.
Die zu trennenden Proben werden als Bande aufgetragen.
Vergessen Sie nicht die Laufmittelfront zu markieren.
Markieren Sie alle Banden im getrockneten Chromatogramm.
Trennung von Aminosäuren durch DC
Untersuchen Sie das Stoffgemisch und die Lösungen der 3 AS mit Hilfe der Dünnschichtchromatografie.
stationäre Phase: Kieselgel-Fertigfolie POLYGRAM SIL G/UV254
mobile Phase: n-Butanol-Eisessig-Wasser (4:1:1, v/v)
zu trennende Probe(n):
Gemisch aus 4 Aminosäuren (gegeben),
3 einzelne Aminosäure-Lösungen (Lys, Ala, Val oder Leu)
(Lösung der AS: einige Kristalle der AS in 2 ml Wasser und 2 ml Ethanol)
Sichtbarmachen:
Als Sprühreagenz dient eine methanolische Ninhydrinlösung; anschließend folgt Erhitzen im Trockenschrank bei 110 °C während 5 Minuten.
Durchführung
- Stellen Sie ca. 20 ml der mobilen Phase her.
Stellen Sie alle Materialien zur DC bereit. - Tragen Sie die Proben jeweils punktförmig auf die DC-Folie auf.
- Entwickeln Sie das Chromatogramm im Laufmittel (nach 60 Minuten ist die Trennung abgeschlossen). Fönen Sie es unter dem Abzug gut trocken.
- Besprühen Sie unter dem Abzug mit Ninhydrin-Lösung (Spraydose bzw. Sprüher).
Bei Sprüher:
Füllen Sie 5 – 10 ml Sprühreagenz in den Sprüher und besprühen Sie die Folie auf einer Filterpapierunterlage so, dass sie leicht durchfeuchtet ist. Mit dem Fön wird die Folie getrocknet und der Sprühvorgang wiederholt.
Anschließend wird die Folie etwa 5 Minuten bei 110 °C in den Trockenschrank gelegt. Die Temperatur darf 130 °C nicht überschreiten. Warum?
Untersuchung eines Stoffgemisches
Untersuchen Sie das Stoffgemisch und die 2 Vergleichsfarbstoffe mit Hilfe der Dünnschichtchromatografie.
Gegeben:
Stoffgemisch aus zwei verschiedenen Farbstoffen,
zwei reine Vergleichssubstanzen
stationäre Phase: DC-Fertigfolie POLYGRAM Cell 300
mobile Phase: Lösungsmittelgemisch mit Ammoniak, selber herstellen
Durchführung
Für das Laufmittel benötigen Sie 2 Flüssigkeiten:
(1) 2,5%ige Natriumcitratlösung
(2) 25%iger methanolischer Ammoniak (gegeben, unter dem Abzug)
Durchführung:
- Stellen Sie die 2,5 % Natriumcitratlösung her.
- Mischen Sie unter dem Abzug und direkt in die Trennkammer:
10 ml der hergestellten 2,5 % Natriumcitratlösung mit 4 ml methanolischem Ammoniak. - Tragen Sie die Proben jeweils punktförmig auf die DC-Folie auf.
- Entwickeln Sie das Chromatogramm ca. 5 Minuten im Laufmittel, und fönen Sie es unter dem Abzug gut trocken.
- Ermitteln Sie die Rf-Werte aller Stoffe.


